化学反应中能量的转化 知识点题库
化学中有许多的“守恒相等”,下列不符合的是( )
A . 化学反应中,反应物总能量与生成物总能量
B . 化学反应中,反应物总质量与生成物总质量
C . 溶液中,稀释前溶质质量与稀释后溶质质量
D . 在化合物中,正化合价总数与负化合价总数
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.
-
(1) 从能量的角度看,断开化学键要(填“放出”或“吸收”)能量.已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、300kJ.则由H2和I2反应生成1mol HI需要(填“放出”或“吸收”) kJ的热量.
-
(2) 某兴趣小组为研究原电池原理,设计如图1装置:
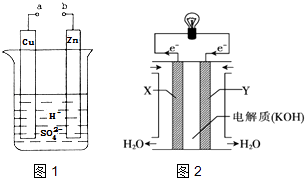
①a和b用导线连接,Zn发生(填“氧化”或“还原”)反应.其电极反应式为.溶液H+移向(填“Cu”或“Zn”)极.
②无论a和b是否连接,Zn片均被腐蚀.若转移了0.4mol电子,则理论上Zn片质量减轻 g.
-
(3) ①目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O
 2Ni(OH)2+Cd(OH)2 , 已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是(填序号).
2Ni(OH)2+Cd(OH)2 , 已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是(填序号). a.以上反应是可逆反应 b.充电时化学能转变为电能 c.放电时化学能转变为电能
②图2为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的(填“正”或“负”)极,Y极的电极反应方程式为.
下列说法中正确的是( )
A . 在化学反应过程中,发生物质变化的同时不一定发生能量变化
B . 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应
C . 反应产物的总焓大于反应物的总焓时,反应吸热,△H>0
D . △H的大小与热化学方程式的计量系数无关
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答(1)~(5)题。
-
(1) 下列物质本身具有的能量最低的是______________。A . H2 B . Cl2 C . Br2 D . I2
-
(2) 下列氢化物中,最稳定的是______________。A . HCl B . HBr C . HI
-
(3) X2+H2=2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?答:。
-
(4) 相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是。
已知1molH—H、Br—Br和H—Br键断裂时需要吸收的能量分别是436kJ、200kJ和369kJ,氢气与溴蒸汽化合生成1mol溴化氢时放出的能量akJ,则a为( )
A . -102
B . -51
C . 102
D . 51
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。气态时,已知断裂1mol N—N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )
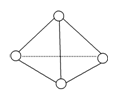
A . N4与N2互称为同位素
B . N4属于一种新型的化合物
C . N4化学性质比N2稳定
D . 1mol N4气体转化为N2时要放出882kJ能量
下列说法错误的是( )
A . 任何化学反应都伴随着能量变化
B . 化学反应中的能量变化都表现为热量的变化
C . 反应物的总能量高于生成物的总能量时,发生放热反应
D . 热化学方程式中,化学计量数表示物质的物质的量。
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )
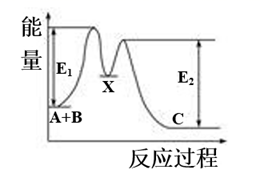
A . X是反应A+B→C的催化剂
B . 反应A+B→C的ΔH<0
C . E2表示反应X→C的活化能
D . 加入催化剂可改变反应A+B→C的焓变
下列关于能量变化的说法,正确是( )
A . 物质发生化学反应时不一定伴随着能量变化
B . 2Na+ 2H2O= 2NaOH+H2↑该反应生成物的总能量高于反应物的总能量
C . 放热反应中,反应物的总能量大于生成物的总能量
D . 有化学键断裂的是吸热过程,并且一定发生了化学变化
下列关于化学反应中物质或能量变化的判断正确的是( )
A . 加热条件下进行的化学反应一定是吸热反应
B . 化学键的断裂和形成是化学反应中能量变化的主要原因
C . 一定条件下进行的化学反应,只能将化学能转化为热能和光能
D . 将NH4Cl固体与Ba(OH)2·8H2O固体混合并搅拌,反应放出热量
臭氧层中臭氧分解过程如图所示,下列说法正确的是( )
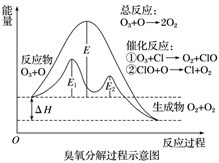
A . 催化反应①②均为放热反应
B . E1是催化反应①对应的正反应的活化能,(E2+ΔH)是催化反应②对应的逆反应的活化能。
C . 决定O3分解反应速率的是催化反应②。
D . 温度升高,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,且平衡常数增大。
已知A、Y、Z、B四种元素分别是元素周期表中连续三个短周期的主族元素,且原子序数依次增大。Y的最外层电子数是其电子层数的3倍,且Y、Z同主族。
-
(1) A、B两种元素的元素符号:A、B。
-
(2) 由A、Z所形成的化合物A2Z的电子式是,化合物类型是 (填“离子化合物”或“共价化合物”)。
-
(3) 由A、Y两元素形成的四核18电子的化合物的电子式为,结构式为 ,由A、Y、B所形成的化合物AYB的电子式是, 存在的化学键。
-
(4) 化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是___________。
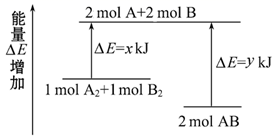 A . 该反应是放热反应 B . 断裂1 mol A-A键和1 mol B-B键能放出x kJ能量 C . 断裂2 mol A-B键需要吸收y kJ的能量 D . 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
A . 该反应是放热反应 B . 断裂1 mol A-A键和1 mol B-B键能放出x kJ能量 C . 断裂2 mol A-B键需要吸收y kJ的能量 D . 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
电石(CaC2)是一种用于生产乙炔的浅色固体。它是由氧化钙与焦炭反应形成的:CaO+3C  CaC2+CO。德国化学家维勒发现,电石与水反应释放出乙炔气体(C2H2)和氢氧化钙,也含有H2S、PH3等杂质气体。
CaC2+CO。德国化学家维勒发现,电石与水反应释放出乙炔气体(C2H2)和氢氧化钙,也含有H2S、PH3等杂质气体。
 CaC2+CO。德国化学家维勒发现,电石与水反应释放出乙炔气体(C2H2)和氢氧化钙,也含有H2S、PH3等杂质气体。
CaC2+CO。德国化学家维勒发现,电石与水反应释放出乙炔气体(C2H2)和氢氧化钙,也含有H2S、PH3等杂质气体。 回答下列问题:
-
(1) 上述六种元素中,电负性最大的是(填写元素名称),原子半径最大者在基态时核外电子占据的轨道数目为个。
-
(2) H2S、PH3分子中心原子的价层电子对数目(填“相同”或“不同”)。根据等电子原理,画出C
 离子的电子式,乙炔分子中C原子的杂化方式为。
离子的电子式,乙炔分子中C原子的杂化方式为。
-
(3) 已知键能数据如下表:
化学键
N-N
N= N
N=N
键能/kJ.mol-1
247
418
942
化学键
C-O
C=O
C=O
键能/kJ. mol-1
351
745
1072
请解释CO比N2容易发生反应:。
-
(4) 如图为电石的四方晶胞(长方体),钙离子位于,它填入C
 离子围成的八面体空隙。计算一个晶胞内含有化学式的数量为。
离子围成的八面体空隙。计算一个晶胞内含有化学式的数量为。 
-
(5) 已知电石密度为2.13 g·cm-3 , 阿伏加德罗常数为6.02×1023 mol-1 , x、y值均为a
 (1
(1  =10-10m),则z=nm(用含a的式子表示,且数字保留整数)。已知a<4.0,则距离钙最近的C
=10-10m),则z=nm(用含a的式子表示,且数字保留整数)。已知a<4.0,则距离钙最近的C  中心有个。
中心有个。
依据图示关系,下列说法错误的是( )
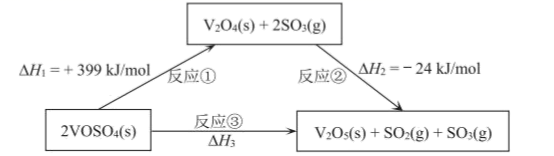
A . 反应①是吸热反应
B . △H3=△H1+△H2
C . 反应③是一个熵增的反应
D . 数据表明:V2O5(s)的能量比V2O4(s)低,更稳定
下列依据热化学方程式得出的结论正确的是( )
A .  为放热反应,则该反应的反应物总能量低于生成物总能量
B . 若C(石墨,
为放热反应,则该反应的反应物总能量低于生成物总能量
B . 若C(石墨,  )
) 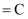 (金刚石,s)
(金刚石,s) 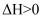 ,则石墨比金刚石稳定
C . 由
,则石墨比金刚石稳定
C . 由 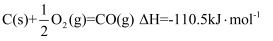 ,可知碳的燃烧热为
,可知碳的燃烧热为 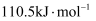 D . 已知
D . 已知 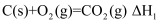 ;
; 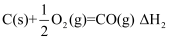 ,则
,则 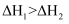
 为放热反应,则该反应的反应物总能量低于生成物总能量
B . 若C(石墨,
为放热反应,则该反应的反应物总能量低于生成物总能量
B . 若C(石墨,  )
) 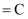 (金刚石,s)
(金刚石,s) 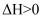 ,则石墨比金刚石稳定
C . 由
,则石墨比金刚石稳定
C . 由 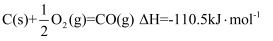 ,可知碳的燃烧热为
,可知碳的燃烧热为 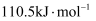 D . 已知
D . 已知 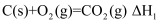 ;
; 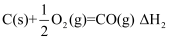 ,则
,则 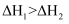
1,3-丁二烯与HBr发生加成反应分两步:第一步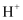 进攻1,3-丁二烯生成碳正离子;第二步
进攻1,3-丁二烯生成碳正离子;第二步 进攻碳正离子发生1,2-加成或1,4-加成。反应进程中的能量变化如图,下列说法正确的是( )
进攻碳正离子发生1,2-加成或1,4-加成。反应进程中的能量变化如图,下列说法正确的是( )
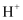 进攻1,3-丁二烯生成碳正离子;第二步
进攻1,3-丁二烯生成碳正离子;第二步 进攻碳正离子发生1,2-加成或1,4-加成。反应进程中的能量变化如图,下列说法正确的是( )
进攻碳正离子发生1,2-加成或1,4-加成。反应进程中的能量变化如图,下列说法正确的是( )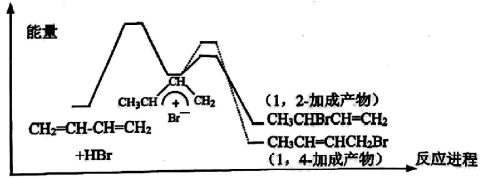
A . 1,2-加成产物比1,4-加成产物稳定
B . 1,2-加成产物与1,4-加成产物互为同系物
C . 两种产物均可发生加聚反应,且加聚反应后的产物不同
D . 1,3-丁二烯与HBr加成反应过程中的两步反应均为放热反应
下列化学反应符合如图反应过程与能量变化关系的是( )
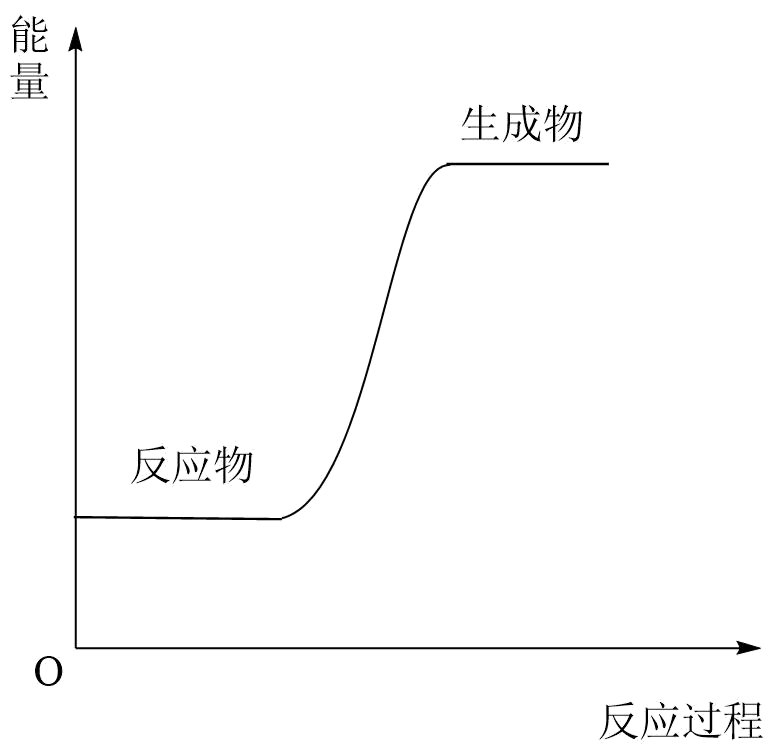
A . 盐酸与KOH溶液反应
B . 甲烷在空气中燃烧
C . 氧化钙与水反应
D . Ba(OH)2•8H2O与NH4Cl反应
已知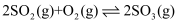 为放热反应,相关说法中正确的是( )
为放热反应,相关说法中正确的是( )
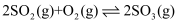 为放热反应,相关说法中正确的是( )
为放热反应,相关说法中正确的是( )
A . 适当升温,正反应速率减小,逆反应速率增大
B . 相同条件下,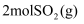 和
和 的总能量一定高于
的总能量一定高于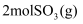 的总能量
C . 该反应达到化学平衡时,各物质浓度保持不变,且一定等于化学计量数(系数)之比
D . 使用适当的催化剂,既能加快该反应的速率,又能提高
的总能量
C . 该反应达到化学平衡时,各物质浓度保持不变,且一定等于化学计量数(系数)之比
D . 使用适当的催化剂,既能加快该反应的速率,又能提高 的平衡转化率
的平衡转化率
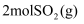 和
和 的总能量一定高于
的总能量一定高于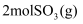 的总能量
C . 该反应达到化学平衡时,各物质浓度保持不变,且一定等于化学计量数(系数)之比
D . 使用适当的催化剂,既能加快该反应的速率,又能提高
的总能量
C . 该反应达到化学平衡时,各物质浓度保持不变,且一定等于化学计量数(系数)之比
D . 使用适当的催化剂,既能加快该反应的速率,又能提高 的平衡转化率
的平衡转化率
沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。已知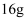 甲烷完全燃烧生成液态水时放出
甲烷完全燃烧生成液态水时放出 热量。下列说法错误的是( )
热量。下列说法错误的是( )
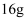 甲烷完全燃烧生成液态水时放出
甲烷完全燃烧生成液态水时放出 热量。下列说法错误的是( )
热量。下列说法错误的是( )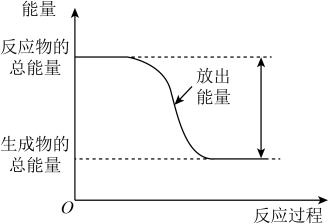
A . 沼气属于可再生能源
B . 沼气的主要成分是 C . 反应生成气态水时放出的热量大于
C . 反应生成气态水时放出的热量大于 D . 反应过程中能量变化可用图表示
D . 反应过程中能量变化可用图表示
 C . 反应生成气态水时放出的热量大于
C . 反应生成气态水时放出的热量大于 D . 反应过程中能量变化可用图表示
D . 反应过程中能量变化可用图表示
反应物(S)转化为产物(P或 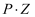 )的能量与反应进程的关系如下图所示:
)的能量与反应进程的关系如下图所示:
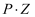 )的能量与反应进程的关系如下图所示:
)的能量与反应进程的关系如下图所示:
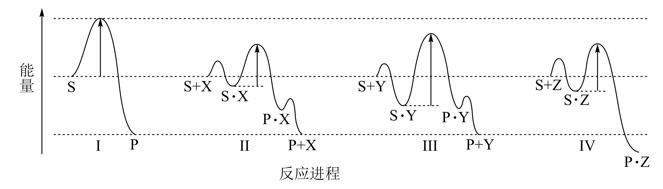
下列有关四种不同反应进程的说法正确的是( )
A . 进程Ⅰ是放热反应
B . 平衡时P的产率:Ⅱ>Ⅰ
C . 生成P的速率:Ⅲ>Ⅱ
D . 进程Ⅳ中,Z没有催化作用
最近更新



