化学反应中能量的转化 知识点题库
下列对化学反应的认识错误的是( )
A . 一定会发生电子转移
B . 有旧键断裂和新键的形成
C . 原子一定发生重新组合
D . 必然伴随着能量的变化
根据热化学方程式S(l)+O2(g)═SO2(g)△H=﹣293.23kJ•mol﹣1分析,下列说法中正确的是( )
A . S(s)+O2(g)═SO2(g),反应放出的热量大于293.23 kJ•mol﹣1
B . S(g)+O2(g)═SO2(g),反应放出的热量小于293.23 kJ•mol﹣1
C . 1 mol SO2的键能总和大于1 mol硫和1 mol氧气的键能之和
D . 1 mol SO2的键能总和小于1 mol硫和1 mol氧气的键能之和
利用含碳化合物合成新燃料是发展低碳经济的重要方法,已知CO(g)+2H2(g)  CH3OH(g)的反应过程中能量变化情况如图所示。下列判断正确的是( )
CH3OH(g)的反应过程中能量变化情况如图所示。下列判断正确的是( )
 CH3OH(g)的反应过程中能量变化情况如图所示。下列判断正确的是( )
CH3OH(g)的反应过程中能量变化情况如图所示。下列判断正确的是( )
A . 生成1 mol CH3OH(g)吸收91 kJ能量
B . 用碳制备原料气CO、H2的反应属于放热反应
C . 反应物的总能量大于生成物的总能量
D . 如果该反应生成液态CH3OH,则释放的热量更少
下列关于能量变化的说法正确的是( )
A . 冰融化成水放出热量
B . 化学键断裂过程一定放出能量
C . 生成物的总能量一定低于反应物的总能量
D . 化学键的断裂和形成是化学反应中能量变化的主要原因
化学与能源开发、环境保护、资源利用等密切相关,下列说法正确的是( )
A . 风力发电和火力发电都是将化学能转化为电能
B . “有计划的开采煤、石油和天然气,大力发展新能源汽车”符合 “低碳经济”发展的新理念
C . 硫的氧化物和碳的氧化物都是形成酸雨的主要物质
D . 可燃冰实质是水变成的固态油
回答下列问题
-
(1) 画出磷原子的原子结构示意图:。
-
(2) 写出H2S分子的电子式:。
-
(3) 写出表示含有8个质子,10个中子的原子的化学符号:。
-
(4) 已知阴离子aXm—和阳离子bYn+具有相同的核外电子排布,则a、
B、m、n之间的关系为a=。
-
(5) 用电子式表示氯化镁的形成过程:。
-
(6) 写出Na2O2中所含化学键的类型。
-
(7) 拆开1mol H—H键,1mol N—H键, 1mol
 键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3热量(填“吸收”或“放出”)kJ;
键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3热量(填“吸收”或“放出”)kJ;
-
(8) 利用下列反应:Fe+Cu2+=Fe2++Cu 制一个化学电池,写出电极反应式:负极:;正极__。
从能量的角度看,断开化学键要,形成化学键要。一个化学反应是释放能量还是吸收能量取决于。
对于反应Zn+H2SO4=ZnSO4+H2↑,下列叙述错误的是( )

A . 反应过程中的能量关系可用上图表示
B . 若将其设计为原电池,则该反应能量转化形式发生改变
C . 若将其设计为原电池,电极可选用锌电极和石墨电极,电解质溶液为稀硫酸。
D . 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体为22.4L(标况)
化学反应N2+3H2  2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )
 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )

A . N2(g)+3H2(g)  2NH3(l) ΔH=(a-b-c)kJ·mol-1
B . N2(g)+3H2(g)
2NH3(l) ΔH=(a-b-c)kJ·mol-1
B . N2(g)+3H2(g)  2NH3(g) ΔH=(b+c-a)kJ·mol-1
C . N2(g)+3H2(g)
2NH3(g) ΔH=(b+c-a)kJ·mol-1
C . N2(g)+3H2(g)  2NH3(l) ΔH=2(a-b-c)kJ·mol-1
D . N2(g)+H2(g)
2NH3(l) ΔH=2(a-b-c)kJ·mol-1
D . N2(g)+H2(g)  NH3(g) ΔH=(b+c+a)kJ·mol-1
NH3(g) ΔH=(b+c+a)kJ·mol-1
 2NH3(l) ΔH=(a-b-c)kJ·mol-1
B . N2(g)+3H2(g)
2NH3(l) ΔH=(a-b-c)kJ·mol-1
B . N2(g)+3H2(g)  2NH3(g) ΔH=(b+c-a)kJ·mol-1
C . N2(g)+3H2(g)
2NH3(g) ΔH=(b+c-a)kJ·mol-1
C . N2(g)+3H2(g)  2NH3(l) ΔH=2(a-b-c)kJ·mol-1
D . N2(g)+H2(g)
2NH3(l) ΔH=2(a-b-c)kJ·mol-1
D . N2(g)+H2(g)  NH3(g) ΔH=(b+c+a)kJ·mol-1
NH3(g) ΔH=(b+c+a)kJ·mol-1
在一定温度下,H2(g)+I2(g)  2HI(g)反应达到了化学平衡,其反应过程对应的能量变化如图所示。下列说法正确的是( )
2HI(g)反应达到了化学平衡,其反应过程对应的能量变化如图所示。下列说法正确的是( )
 2HI(g)反应达到了化学平衡,其反应过程对应的能量变化如图所示。下列说法正确的是( )
2HI(g)反应达到了化学平衡,其反应过程对应的能量变化如图所示。下列说法正确的是( ) 
A . 该反应为放热反应
B . 该反应的△H=Ea'-Ea
C . 该反应中加入催化剂,可增大反应速率,同时改变焓变
D . 温度升高,单位体积的活化分子百分数增加,反应速率加快,且平衡逆向移动
HNO2与羟基自由基(·OH)的气相氧化反应与酸雨、光化学烟雾等重大环境问题密切相关。水分子可作为该气相氧化反应的催化剂,图中表示水分子催化的一种机理:下列叙述错误的是( )

A . 该气相氧化反应的化学方程式为HNO2+·OH  NO2+H2O
B . 反应历程中还可能形成HONO···H2O
C . 该反应历程中最大能垒(活化能)为201.1kJ·mol-1
D .
NO2+H2O
B . 反应历程中还可能形成HONO···H2O
C . 该反应历程中最大能垒(活化能)为201.1kJ·mol-1
D .  是反应过渡态
是反应过渡态
 NO2+H2O
B . 反应历程中还可能形成HONO···H2O
C . 该反应历程中最大能垒(活化能)为201.1kJ·mol-1
D .
NO2+H2O
B . 反应历程中还可能形成HONO···H2O
C . 该反应历程中最大能垒(活化能)为201.1kJ·mol-1
D .
一定条件下氨气和氯气反应的能量与反应过程如图所示,下列说法正确的是( )

A . 相同条件下Cl2比HCl稳定
B . 过程I:断裂极性键和非极性键
C . 过程Ⅱ:形成极性键和非极性键
D . 热化学方程式为NH3(g)+Cl2(g)→NH2Cl(g)+HCl(g) △H=+11.3KJ
某种含二价铜微粒[CuII(OH)(NH3)]+的催化剂可用于汽车尾气脱硝。催化机理如图1,反应过程中不同态物质能量变化如图2.下列说法错误的是( )

A . 由图2可知,该总反应为放热反应
B . 状态③到状态④的变化过程中有O-H键的形成
C . 状态④到状态⑤中,NO发生氧化反应
D . 该脱硝过程的总反应方程式为4NH3+2NO+2O2=N2+6H2O
氢燃料电池汽车每投放100万辆,一年可减少二氧化碳排放5.1亿吨,这将极大助力碳中和目标实现。下列有关氢燃料电池说法错误的是( )
A . 发展氢燃料电池汽车需要安全高效的储氢技术
B . 理论上氢燃料电池汽车使用时不会产生污染物
C . 氢燃料电池汽车直接将化学能转化为动能
D . 氢燃料电池汽车运行不排放二氧化碳
如图是石墨、足球烯(C60)、金刚石三种晶体的结构示意图,下列说法正确的是( )
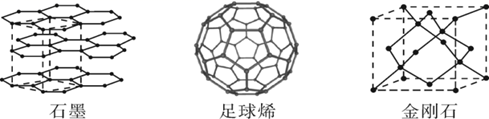
A . 这三种物质是碳的同分异构体,燃烧产物相同
B . 这三种物质熔化时,克服的粒子间作用力完全相同
C . 等物质的量的石墨、金刚石所含的C—C键数目之比为3:4
D . 已知C(s,石墨)=C(s,金刚石)ΔH=+1.9kJ·mol-1 , 则金刚石比石墨稳定
合理运用化学原理知识对于生产、生活以及环境保护有着重要意义。下列说法正确的是( )
A . 化学反应过程中都伴随着能量的变化,主要形式是热能。所有的吸热反应都需要加热才能实现
B . 许多在通常条件下不能发生的氧化还原反应,可以通过电解实现
C . 钢铁制造的暖气管道外常涂有一些沥青,这是钢铁的电化学保护法
D . 锂-空气电池是一种可充电电池,可选用有机电解液或水性电解液
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。

已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
-
(1) 图中A、C分别表示、,E的大小对该反应的反应热(填“有”或“无”)影响;
-
(2) 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
-
(3) 图中ΔH=kJ·mol-1;
-
(4) 已知单质硫的燃烧热ΔH=-296 kJ·mol-1 , 计算由S(s)生成1 mol SO3(g)的ΔH(写出计算过程)。
化学与生活息息相关,下列说法正确的是( )
A . 食物储藏在冰箱中,主要目的是便于食物的分类放置
B . 为减少汽车尾气污染,可在排气管处设置催化转化装置
C . “冰,水为之,而寒于水”,说明冰的能量一定低于水
D . 使用水煤气的家庭灶具,可直接改用天然气
相关有机物分别与氢气发生加成反应生成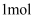 环己烷(
环己烷( )的能量变化如图所示:
)的能量变化如图所示:
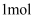 环己烷(
环己烷(
由图得出的推理错误的是( )
A . 苯分子中不存在三个完全独立的碳碳双键
B . 碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
C . 位置异构形成的同分异构体之间的性质不完全相同
D . 单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
已知化学反应 的能量变化如图所示,下列叙述中正确的是( )
的能量变化如图所示,下列叙述中正确的是( )
 的能量变化如图所示,下列叙述中正确的是( )
的能量变化如图所示,下列叙述中正确的是( )
A . 该反应的 B . 加入催化剂可以改变反应的焓变
C . 当生成1mol气态AB时,吸收
B . 加入催化剂可以改变反应的焓变
C . 当生成1mol气态AB时,吸收 能量
D . 断裂1molA-A键和1molB-B键共吸收
能量
D . 断裂1molA-A键和1molB-B键共吸收 能量反应过程
能量反应过程
 B . 加入催化剂可以改变反应的焓变
C . 当生成1mol气态AB时,吸收
B . 加入催化剂可以改变反应的焓变
C . 当生成1mol气态AB时,吸收 能量
D . 断裂1molA-A键和1molB-B键共吸收
能量
D . 断裂1molA-A键和1molB-B键共吸收 能量反应过程
能量反应过程
最近更新



