化学平衡中反应条件的控制 知识点
化学平衡中反应条件的控制 知识点题库
一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2 (g) + O2 (g) 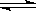 2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是( )
2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是( )
T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.
(1)容器中发生的反应可表示为
(2)反应进行的前3min内,用X表示的反应速率 v(X)= mol/(L•min)
(3)保持其他条件不变,升高温度,该反应的化学平衡将向 方向移动(填“正反应”或“逆反应”)
(4)①若改变反应条件,使反应进程如图3所示,则改变的条件是
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是 (填字母代号).
a.高温高压 b.加入催化剂 c.减少Z的浓度 d.增加气体Y的浓度.
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
CO | H2O | CO2 | H2 | CO2 | ||
1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
下列说法正确的是( )
 D . 实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol
D . 实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol
-
(1) 臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:
6Ag(s)+O3(g)═3Ag2O(s)△H=﹣235.8kJ/mol.
已知2Ag2O(s)═4Ag(s)+O2(g)△H=+62.2kJ/mol,
则常温下反应:2O3(g)═3O2(g)的△H=.
-
(2) 科学家首先使用在酸性条件下电解水的方法制得臭氧.臭氧在阳极周围的水中产生,电极反应式为3H2O﹣6e﹣=O3↑+6H+ , 阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为.
-
(3) O3在碱性条件下可将Na2SO4氧化成Na2S2O8并生成氧气.写出该反应的化学方程式:
-
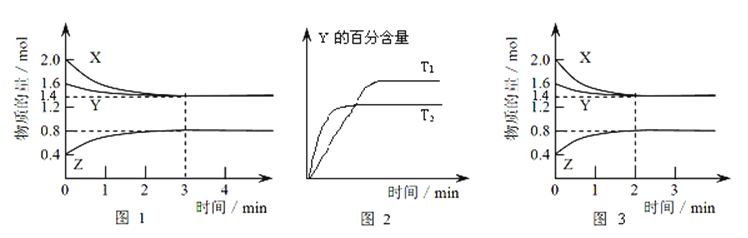
(4) 所得的Na2S2O8溶液可降解有机污染物4﹣CP.原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4﹣•).通过测定4﹣CP降解率可判断Na2S2O8溶液产生SO4﹣•的量.某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4﹣•的影响.
①溶液酸碱性的影响:其他条件相同,将4﹣CP加入到不同pH的Na2S2O8溶液中,结果如图a所示.由此可知:溶液酸性增强,(填“有利于”或“不利于”)Na2S2O8产生SO4﹣ .
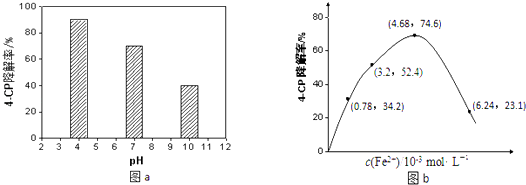
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4﹣CP)=1.56×10﹣4mol•L﹣1、c(Na2S2O8)=3.12×10﹣3 mol•L﹣1的混合溶液中.反应240min后测得实验结果如图b所示.已知 S2O82﹣+Fe2+═SO4﹣•+SO42﹣+Fe3+ . 则由图示可知下列说法正确的是:(填序号)
A.反应开始一段时间内4﹣CP降解率随Fe2+浓度的增大而增大,原因是Fe2+能使Na2S2O8产生更多的SO4ˉ•.
B.Fe2+是4﹣CP降解反应的催化剂
C.当c(Fe2+)过大时,4﹣CP降解率反而下降,原因可能是Fe2+会与SO4﹣•发生反应,消耗部分SO4﹣•.
D.4﹣CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于4﹣CP的降解.
③当c(Fe2+)=3.2×10ˉ3mol•L﹣1时,4﹣CP降解的平均反应速率的计算表达式为.
-
(1) 若A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n和p的关系是.
-
(2) 若A、C是气体,增加B的量,平衡不移动,则B的状态为.
-
(3) 若A、C是气体,而且 m+n=p,增大压强可使平衡发生移动,则平衡向(填“正”或“逆”)反应方向移动.
-
(4) 若加热后,可使C的质量增加,则正反应是(填“放热”或“吸热”)反应.
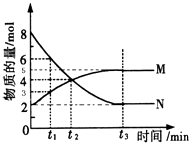
-
(1) 比较t2时刻,正逆反应速率大小v正 v逆 . (填“>”、“=”、“<”)
-
(2) 若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:
-
(3) t3时刻化学反应达到平衡时反应物的转化率为
-
(4) 如果升高温度则v逆(填增大、减小或不变).
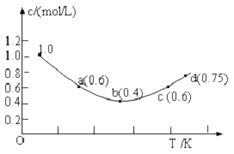
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度.
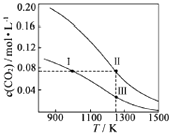
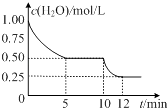
 2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是( )
2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是( )
 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
 >1
D . 达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17
>1
D . 达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
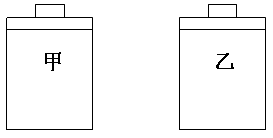
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
| 容器编号 | 容器类型 | 初始体积 | 起始物质的量/mol | 平衡时SO3物质的量/mol | ||
| SO2 | O2 | SO3 | ||||
| I | 恒温恒容 | 1.0 L | 2 | 1 | 0 | 1.6 |
| II | 绝热恒容 | 1.0 L | 2 | 1 | 0 | a |
| III | 恒温恒压 | 2.0 L | 0 | 0 | 4 | b |



