化学平衡中反应条件的控制 知识点题库
已知(HF)2(g)⇌2HF(g),△H>0且平衡体系的总质量【m(总)】与总物质的量【n总】之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( )

A . 温度:T1<T2
B . 平衡常数:K(a)=K(b)<K(c)
C . 反应速率:Vb>Va
D . 当 =30g/mol时,n(HF):n[(HF)2]=2:1
=30g/mol时,n(HF):n[(HF)2]=2:1
 =30g/mol时,n(HF):n[(HF)2]=2:1
=30g/mol时,n(HF):n[(HF)2]=2:1
已知2A(g)+B(g)⇌n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )

A . 该反应正反应是吸热反应
B . 反应温度升高,A的转化率增大
C . 平衡状态由a变到b时,化学平衡常数K(A)小于K(B)
D . 容器内气体的平均相对分子质量不变,说明反应达到化学平衡状态
下列关于化学反应速率和化学反应限度的说法中正确的是( )
A . 化学反应速率是衡量化学反应进行快慢程度的物理量
B . 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示
C . 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度,即使条件改变,该限度都不会改变
D . 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)⇌PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A . 反应在前50s的平均速率为v(PCl3)=0.0032mol•L﹣1•s﹣1
B . 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L﹣1 , 则反应的△H<0
C . 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2 , 达到平衡前v(正)>v(逆)
D . 相同温度下,起始时向容器中充入2.0mol PCl3、2.0mol Cl2 , 达到平衡时,PCl3的转化率小于80%
现向一密闭容器中充入1mol N2和3mol H2 , 在一定条件下发生反应:N2+3H2⇌2NH3 . 下列有关说法正确的是( )
A . 达到化学平衡时,有2molNH3生成
B . 达到化学平衡时,正反应和逆反应的速率均为零
C . 达到化学平衡时,N2、H2和NH3的物质的量不再变化
D . 达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2
在一密闭容器中,反应aA(g)⇌bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
A . 平衡向正反应方向移动了
B . 平衡向逆反应方向移动了
C . 物质B的质量分数增加了
D . a<b
在一定条件下,发生CO+NO2⇌CO2+NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是( )
A . 正反应为吸热反应
B . 正反应为放热反应
C . 降温后CO的浓度增大
D . 降温后各物质的浓度不变
可逆反应的条件改变后,υ(正)与时间关系如图所示,X、Y、Z、W四点中,υ(逆)最大的是( )

A . X
B . Y
C . Z
D . W
汽车尾气产生NO的反应为:N2(g)+O2(g)⇌2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )

A . 曲线b对应的条件改变可能是加入了催化剂
B . 温度T下,随着反应的进行,混合气体的密度减小
C . 温度T下,该反应的平衡常数K=  D . 若曲线b对应的条件改变是温度,可判断该反应是吸热反应
D . 若曲线b对应的条件改变是温度,可判断该反应是吸热反应
 D . 若曲线b对应的条件改变是温度,可判断该反应是吸热反应
D . 若曲线b对应的条件改变是温度,可判断该反应是吸热反应
某温度下,浓度都是1mol•L﹣1的两种气体X2和Y2 , 在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4mol•L﹣1 , c(Y2)=0.6mol•L﹣1 , c(Z)=0.4mol•L﹣1 , 则该反应的化学方程式可表示为( )
A . 2X2+3Y2⇌2X2Y3
B . 3X2+2Y2⇌2X3Y2
C . X2+2Y2⇌XY2
D . 2X2+Y2⇌2X2Y
在容积为2L的3个密闭容器中发生反应3A(g)+B(g)⇌xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3mol A、2mol B | 6mol A、4mol B | 2mol C |
到达平衡的时间(min) | 5 | 8 | |
A的浓度(mol/L) | c1 | c2 | |
C的体积分数 | w1 | w3 | |
混合气体密度(g/L) | ρ1 | ρ2 |
下列说法正确的是( )
A . 若x<4,则2c1<c2
B . 若w3=w1 , 可断定x=4
C . 无论x的值是多少,均有2ρ1=ρ2
D . 容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol•L﹣1•min﹣1
某化学研究小组探究外界条件对化学反应mA(g)+nB(g)⇌pC(g)的速率和平衡的影响图象如下,下列判断正确的是( )

A . 由图1可知,T1<T2 , 该反应正反应为吸热反应
B . 由图2可知,该反应m+n<p
C . 图3中,表示反应速率v正>v逆的是点3
D . 图4中,若m+n=p,则a曲线一定使用了催化剂
对于反应  在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时  和
和  均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时  和
和  均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( ) 
A . 实验c条件下,从反应开始至达到平衡时  B . 实验a条件下,用浓度表示的平衡常数为100
C . 该反应的
B . 实验a条件下,用浓度表示的平衡常数为100
C . 该反应的  D . 比较实验a、c可判断升高温度反应速率加快
D . 比较实验a、c可判断升高温度反应速率加快
 B . 实验a条件下,用浓度表示的平衡常数为100
C . 该反应的
B . 实验a条件下,用浓度表示的平衡常数为100
C . 该反应的  D . 比较实验a、c可判断升高温度反应速率加快
D . 比较实验a、c可判断升高温度反应速率加快
高炉炼铁过程中发生的主要反应为 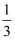 Fe2O3+CO(g)⇌
Fe2O3+CO(g)⇌  Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
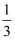 Fe2O3+CO(g)⇌
Fe2O3+CO(g)⇌  Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下: | 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
-
(1) 该反应正反应是热反应(填“吸”或“放”);
-
(2) 欲提高反应中CO的平衡转化率,可采取的措施是______;A . 减少Fe的量 B . 增加Fe2O3的量 C . 移出部分CO2 D . 加入合适的催化剂 E . 增大容器的容积
-
(3) 在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v(CO2)=、CO的平衡转化率=。如果此时向密闭容器中加入CO和CO2各2mol,平衡(填“向正方向”、“向逆方向”、“不”)移动。
-
(4) 在恒温恒容下,下列各项可作为该反应达到平衡状态的标志的是_________。A . 压强不再变化 B . 气体密度不再变化 C . CO的消耗速率与CO2的消耗速率之比为1:1 D . 气体平均摩尔质量不再变化 E . CO与CO2的浓度相等
下列关于化学反应限度的说法中错误的是( )
A . 一定条件下,一个可逆反应达到的平衡状态,就是这个反应此时所能达到的限度
B . 当一个可逆反应达到平衡状态时,那么这个反应的正反应速率和逆反应速率相等
C . 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
D . 化学反应的限度可以通过改变条件而改变
“加大力度保护自然,实现可持续发展”是第五届联合国环境大会会议主题。工业生产产生的含  的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
 的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
-
(1) 在一定条件下,肼(
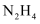 )与
)与 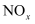 反应能生成
反应能生成  和
和  。
。 已知:①
 ;
;②
 ;
;③
 ;
;则反应
 的
的 
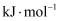 。
。 -
(2) 在一恒容密闭容器中发生反应:
 。当温度高于250℃时,正、逆反应速率分别为
。当温度高于250℃时,正、逆反应速率分别为  分别为正、逆反应速率常数,
分别为正、逆反应速率常数,  、
、  与该反应的平衡常数
与该反应的平衡常数 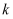 之间的关系为。速率常数
之间的关系为。速率常数 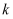 随温度的升高而增大,则达到平衡后,仅升高温度,
随温度的升高而增大,则达到平衡后,仅升高温度,  增大的倍数(填“>”、“<”或“=”)
增大的倍数(填“>”、“<”或“=”)  增大的倍数。
增大的倍数。
-
(3) 在一定条件下,利用催化净化技术,CO可将NO2转化为无毒物质反应为
 。向两个容积均为2L的恒容密闭容器中均分别充入
。向两个容积均为2L的恒容密闭容器中均分别充入  和
和  ,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为
,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为  ,曲线II代表的体系平衡后气体的总压强为
,曲线II代表的体系平衡后气体的总压强为  。
。 
①代表220℃条件下的变化曲线为(填“I”或“II”);ad段
 的平均反应速率为
的平均反应速率为  。
。②下列有关曲线II条件下的反应的说法正确的是(填标号)。
A.当体系中
 与
与 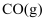 的物质的量之比不随时间变化时,反应达到平衡状态
的物质的量之比不随时间变化时,反应达到平衡状态B.当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.使用高效催化剂可提高
 的转化率
的转化率③图中a、c、d三点对应的逆反应速率由大到小的顺序为(用a、c、d表示);在曲线II代表的温度下,该反应的平衡常数Kp=
 (Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
(Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与 CO(g)发生如下反应:Ni(s)+4CO(g)  Ni(CO)4(g),但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是( )
Ni(CO)4(g),但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是( )
 Ni(CO)4(g),但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是( )
Ni(CO)4(g),但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是( ) 
A . 纯Ni(s)和Ni(CO)4(g)
B . 纯Ni(s)和CO(g)
C . 不纯Ni(s)和CO(g)
D . 不纯Ni(s)和Ni(CO)4(g)
下列关于化学反应速率和化学平衡的说法正确的是( )
A . 反应物之间同时存在多个反应时,理想的催化剂可以提高目标产物在最终产物中的比率
B . 化学平衡正向移动,反应物的转化率一定提高
C . 增大压强,化学反应速率一定增大
D . 温度对可逆反应中放热反应速率的影响程度大于吸热反应
CH4联合H2O和CO2制取H2时,发生的主要反应如下:
①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206kJ·mol-1
CO(g)+3H2(g) △H1=+206kJ·mol-1
②CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247kJ·mol-1
2CO(g)+2H2(g) △H2=+247kJ·mol-1
将CH4、H2O和CO2按一定比例通入填充有催化剂的恒容反应器,在不同温度下,反应相同时间内(反应均未达到化学平衡状态)测得 的值如图所示。
的值如图所示。

下列说法正确的是( )
A . 由①②可知,CO(g)+H2O(g) CO2(g)+H2(g) △H=+41kJ·mol-1
B . 反应条件不变,若反应足够长时间,①比②先达到化学平衡状态
C . 其他条件不变时,升高温度,①的化学反应速率减小,②的化学反应速率增大
D . 其他条件不变时,增大原料中H2O的浓度可以提高产物中
CO2(g)+H2(g) △H=+41kJ·mol-1
B . 反应条件不变,若反应足够长时间,①比②先达到化学平衡状态
C . 其他条件不变时,升高温度,①的化学反应速率减小,②的化学反应速率增大
D . 其他条件不变时,增大原料中H2O的浓度可以提高产物中 的值
的值
 CO2(g)+H2(g) △H=+41kJ·mol-1
B . 反应条件不变,若反应足够长时间,①比②先达到化学平衡状态
C . 其他条件不变时,升高温度,①的化学反应速率减小,②的化学反应速率增大
D . 其他条件不变时,增大原料中H2O的浓度可以提高产物中
CO2(g)+H2(g) △H=+41kJ·mol-1
B . 反应条件不变,若反应足够长时间,①比②先达到化学平衡状态
C . 其他条件不变时,升高温度,①的化学反应速率减小,②的化学反应速率增大
D . 其他条件不变时,增大原料中H2O的浓度可以提高产物中 的值
的值
常温下,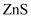 和
和 的沉淀溶解关系如图所示,其中
的沉淀溶解关系如图所示,其中 、
、 , M为
, M为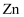 或
或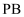 ,
,  表示
表示 。下列说法正确的是( )
。下列说法正确的是( )
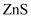 和
和 的沉淀溶解关系如图所示,其中
的沉淀溶解关系如图所示,其中 、
、 , M为
, M为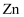 或
或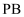 ,
,  表示
表示 。下列说法正确的是( )
。下列说法正确的是( )
A . 常温下,B点为 的不饱和溶液
B . 若
的不饱和溶液
B . 若 , 则
, 则 C . 若对A点浊液加热,A点沿曲线向上移动
D . 在
C . 若对A点浊液加热,A点沿曲线向上移动
D . 在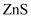 和
和 同时沉淀的浊液中,
同时沉淀的浊液中,
 的不饱和溶液
B . 若
的不饱和溶液
B . 若 , 则
, 则 C . 若对A点浊液加热,A点沿曲线向上移动
D . 在
C . 若对A点浊液加热,A点沿曲线向上移动
D . 在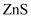 和
和 同时沉淀的浊液中,
同时沉淀的浊液中,
最近更新



