化学平衡移动原理 知识点题库
-
(1)
某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图1所示),大大地提高了资源利用率,减少了环境污染.

①由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)⇌CH3OH(g).
已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
②写出钛铁矿经氯化得到四氯化钛的化学方程式:
③若不考虑生产过程中物质的任何损失,该产业链中每合成38.4t甲醇,至少需额外补充H2 t.
-
(2) 将两个石墨电极插入H2SO4溶液中,向两极分别通入C3H8和O2 , 构成丙烷燃料电池.
①负极电极反应式是: ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图2所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是 (填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e﹣═H2↑
-
(3) 将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下三组数据:
实验组
温度/℃
起始量/mol
平衡量/mol
达到平衡所需时间/min
H2O
CO
CO2
1
650
2
4
1.6
5
2
900
1
2
0.4
3
3
900
1
2
0.4
1
①该反应的正反应为 (填“吸”或“放”)热反应;
②实验2中,平衡常数K= ;
③实验3跟实验2相比,改变的条件可能是 (答一种情况即可).
 Fe(SCN)2+(aq) 已知某一条件下,反应达到平衡时,Fe(SCN)2+的物质的量浓度与温度的关系如图所示,下列说法正确的是( )
Fe(SCN)2+(aq) 已知某一条件下,反应达到平衡时,Fe(SCN)2+的物质的量浓度与温度的关系如图所示,下列说法正确的是( )
 2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
 NaUr(s) + H+(aq) +Q (Q>0),下列说法错误的是( )
NaUr(s) + H+(aq) +Q (Q>0),下列说法错误的是( )
 2NO2(g),当c(N2O4)∶c(NO2)=1∶2时,该可逆反应到达限度
C . 碱性N2H4—空气燃料电池工作时,正极电极反应式为O2+2H2O+4e-=4OH-
D . N2H4的水溶液中存在:N2H4+H2O
2NO2(g),当c(N2O4)∶c(NO2)=1∶2时,该可逆反应到达限度
C . 碱性N2H4—空气燃料电池工作时,正极电极反应式为O2+2H2O+4e-=4OH-
D . N2H4的水溶液中存在:N2H4+H2O  N2H
N2H  +OH- , 向稀溶液中加水稀释,
+OH- , 向稀溶液中加水稀释,  的值变大
的值变大
 2CuBr(s)+Br2(g)达到平衡。保持温度不变,缩小容器体积,体系重新达到平衡,下列说法正确的是( )
2CuBr(s)+Br2(g)达到平衡。保持温度不变,缩小容器体积,体系重新达到平衡,下列说法正确的是( )
 ΔH>0,25℃时,Ka=1.75×10-5 , 是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是( )
ΔH>0,25℃时,Ka=1.75×10-5 , 是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是( )

 溶液中再加入
溶液中再加入  B .
B . 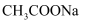 溶液加热
C . 氨水中加入少量
溶液加热
C . 氨水中加入少量  固体
D . 醋酸溶液加热
固体
D . 醋酸溶液加热
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是( )


| 名称 | 熔点/℃ | 沸点/℃ | 燃烧热 ∆H /kJ•mol-1 |
| 正戊烷 | -130 | 36 | –3506.1 |
| 异戊烷 | -159.4 | 27.8 | –3504.1 |
下列说法错误的是( )
-
(1) 上述四种气体中直接排入空气时会引起酸雨的有(填化学式)。
-
(2) 已知:2SO2(g)+O2(g)
 2SO3(g) ∆H=- 196.6 kJ∙mol-1
2SO3(g) ∆H=- 196.6 kJ∙mol-1 2NO(g)+ O2(g)
 2NO2(g) ∆H=-113.0 kJ∙mol-1
2NO2(g) ∆H=-113.0 kJ∙mol-1①反应:NO2(g)+ SO2(g)
 SO3(g)+ NO(g)的∆H=kJ∙mol-1。
SO3(g)+ NO(g)的∆H=kJ∙mol-1。②一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+ SO2(g)
 SO3(g)+NO(g),下列能说明反应达到平衡状态的是(填字母)。
SO3(g)+NO(g),下列能说明反应达到平衡状态的是(填字母)。a.混合气体的密度保持不变 b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变 d.每生成1molSO3的同时消耗1mol NO
③测得②中反应达到平衡时NO与NO2的体积之比为37:13,则在该温度下反应:NO2(g)+ SO2(g)
 SO3(g)+NO(g)的平衡常数K=
SO3(g)+NO(g)的平衡常数K= -
(3) CO可用于合成甲醇,其反应的化学方程式为CO(g) +2H2(g)
 CH3OH(g)。 在一容积可变的密闭容器中充有10molCO与20molH2 , 在催化剂作用下发生反应生成甲醇。CO的平衡转化率(
CH3OH(g)。 在一容积可变的密闭容器中充有10molCO与20molH2 , 在催化剂作用下发生反应生成甲醇。CO的平衡转化率( 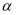 )与温度(T)、压强(p)的关系如图所示。下列说法正确的是_______(填字母)。
)与温度(T)、压强(p)的关系如图所示。下列说法正确的是_______(填字母)。  A . 合成甲醇的反应为吸热反应 B . 压强为p1>p2 C . A,B,C三点的平衡常数为KA= KB> KC D . 若达平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积也为10 L
A . 合成甲醇的反应为吸热反应 B . 压强为p1>p2 C . A,B,C三点的平衡常数为KA= KB> KC D . 若达平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积也为10 L
 和
和  下,
下, 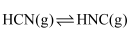 异构化反应过程的能量变化如图所示。下列说法错误的是( )
异构化反应过程的能量变化如图所示。下列说法错误的是( ) 
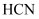 比
比 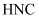 稳定
B . 该异构化反应的
稳定
B . 该异构化反应的  C . 低温下有利于
C . 低温下有利于 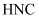 的生成
D . 使用催化剂可以改变反应的活化能
的生成
D . 使用催化剂可以改变反应的活化能
 NO2+SO2
NO2+SO2

 , 以下叙述正确的是( )
, 以下叙述正确的是( )
 的生成速率是
的生成速率是 消耗速率的2倍时,说明反应达到了平衡状态
B . 反应达平衡时,恒温恒容下加入
消耗速率的2倍时,说明反应达到了平衡状态
B . 反应达平衡时,恒温恒容下加入 , 会加快逆反应速率,使平衡逆向移动
C . 反应达平衡时,恒温恒压下通入惰性气体,正反应速率减慢,平衡正向移动
D . 正反应活化能小于逆反应活化能
, 会加快逆反应速率,使平衡逆向移动
C . 反应达平衡时,恒温恒压下通入惰性气体,正反应速率减慢,平衡正向移动
D . 正反应活化能小于逆反应活化能
 2CO(g)+2H2(g) ΔH>0。温度为T℃时,该反应的平衡常数为K。下列说法正确的是( )
2CO(g)+2H2(g) ΔH>0。温度为T℃时,该反应的平衡常数为K。下列说法正确的是( )

 2B(g)
B . 4min时,A,B速率关系为v(A)=v(B)
C . 8min时,A,B气体物质的量不再变化,反应停止
D . 8min后升高温度,平衡会发生移动
2B(g)
B . 4min时,A,B速率关系为v(A)=v(B)
C . 8min时,A,B气体物质的量不再变化,反应停止
D . 8min后升高温度,平衡会发生移动
 4NO(g)+6H2O(g) ΔH<0。在T℃时,向1L密闭容器中投入4molNH3、5molO2 , 平衡时测得NH3的转化率为60%。下列有关氨催化氧化反应的说法正确的是( )
4NO(g)+6H2O(g) ΔH<0。在T℃时,向1L密闭容器中投入4molNH3、5molO2 , 平衡时测得NH3的转化率为60%。下列有关氨催化氧化反应的说法正确的是( )



