化学平衡移动原理 知识点题库
 PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2 , 在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2 , 在相同温度下再达平衡时PCl5的物质的量是( )

 2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化
B . 图②中曲线表示反应2SO2(g)+O2(g)
2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化
B . 图②中曲线表示反应2SO2(g)+O2(g)  2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化
C . 图③表示10 mL0.01 mol/LKMnO4酸性溶液与过量0.1mol/LH2C2O4溶液混合时,n(Mn2+)随时间的变化
D . 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)CH3CH3(g) ΔH<0,使用和未使用催化剂时,反应过程中的能量变化
2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化
C . 图③表示10 mL0.01 mol/LKMnO4酸性溶液与过量0.1mol/LH2C2O4溶液混合时,n(Mn2+)随时间的变化
D . 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)CH3CH3(g) ΔH<0,使用和未使用催化剂时,反应过程中的能量变化
 =0.68 mol/L。回答下列问题:
=0.68 mol/L。回答下列问题:
-
(1) 加入少量KSCN固体后,平衡将向(“正”或“逆”)方向移动。
-
(2) 该反应的平衡常数K为多少?。
-
(3) 加水稀释至原溶液体积的2倍,平衡将向(“正”或“逆”)方向移动。请通过相关计算说明。
 nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则:( )
nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则:( )
-
(1) 判断该反应达到平衡状态的标志是(填序号)。
a.SO2、O2、SO3三者的浓度之比为 2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和 SO3的生成速率相等
-
(2) ①SO2的转化率为;
②达到平衡时反应放出的热量为;
③此温度下该反应的平衡常数 K=。
-
(3) 如图表示平衡时 SO2的体积分数随压强和温度变化的曲线,则:

①温度关系 : T1T2( 填 “>”“<” 或“=”,下同);
②平衡常数关系:KAKB , KAKD。
 Hb(O2)。下列说法正确的是( )
Hb(O2)。下列说法正确的是( )
 Hb(O2)+CO(g)右移
Hb(O2)+CO(g)右移

 Fe(SCN)3↓
B . E点对应的坐标为(0,0.04)
C . 该反应的平衡常数K=
Fe(SCN)3↓
B . E点对应的坐标为(0,0.04)
C . 该反应的平衡常数K=  D . t4时向溶液中加入50mL0.1mol/LKCl溶液,平衡逆向移动
D . t4时向溶液中加入50mL0.1mol/LKCl溶液,平衡逆向移动
 加氢制
加氢制  是
是  资源化利用的重要途径,该过程存在如下两个反应:
资源化利用的重要途径,该过程存在如下两个反应: 反应Ⅰ 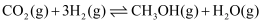

反应Ⅱ 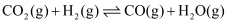

回答下列问题:
-
(1) 根据图(a),
 ,
, 
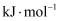 。
。 
-
(2) 在4.0MPa压强下,按
 把两种气体通入恒压反应器中,
把两种气体通入恒压反应器中,  的平衡转化率及
的平衡转化率及  的平衡产率随温度变化关系如图(b)。已知:
的平衡产率随温度变化关系如图(b)。已知: 

①525~575K时,使
 平衡转化率随温度升高而增大的反应为(填“反应Ⅰ”或“反应Ⅱ”)。
平衡转化率随温度升高而增大的反应为(填“反应Ⅰ”或“反应Ⅱ”)。②475K时,平衡体系中
 ,反应Ⅰ的平衡常数
,反应Ⅰ的平衡常数 
 (列出计算式)。
(列出计算式)。 -
(3) 为同时提高
 的平衡转化率和
的平衡转化率和  的平衡产率,除降低温度外,还可采取的措施是(写一条)。
的平衡产率,除降低温度外,还可采取的措施是(写一条)。
-
(4) 利用M催化
 ,加氢制
,加氢制  的反应历程如图,其中吸附在催化剂表面的物种用*表示,
的反应历程如图,其中吸附在催化剂表面的物种用*表示,  表示活化能,单位为eV。
表示活化能,单位为eV。 
①
 转化为
转化为  的化学方程式为。
的化学方程式为。②下列说法正确的是(填标号)。
A.
 与
与  能量差为0.60eV
能量差为0.60eVB.第ii步有
 键断裂
键断裂C.第iii步反应速率最慢
D.加入催化剂M不影响
 的平衡产率
的平衡产率
-
(1) 在一定体积的密闭容器中,进行化学反应CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表: T/℃
700
800
830
1 000
1 200
K
0.6
0.9
1.0
1.7
2.6
回答下列问题:
①该反应的化学平衡常数表达式K=。
②某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为。
③若830 ℃时,向容器中充入1 mol CO、4mol H2O,反应达到平衡后,其化学平衡常数K(填“大于”“小于”或“等于”)1.0。
④若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol∙L−1、2 mol∙L−1、4 mol∙L−1、4 mol∙L−1 , 则此时上述反应的平衡移动方向
-
(2) 图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为、,制得等量H2所需能量较少的是。
-
(3) H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.04。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.04。 ①H2S的平衡转化率
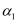 =,反应平衡常数K=。
=,反应平衡常数K=。②在620 K重复试验,平衡后水的物质的量分数为0.05,H2S的转化率

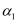 。
。
 zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1 , 当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3 mol·L-1 , 则下列叙述正确的是( )
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1 , 当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3 mol·L-1 , 则下列叙述正确的是( )

下列说法错误的是( )
| 选项 | 实验操作和现象 | 结论或目的 |
| A | 向锌和稀硫酸反应的试管中滴加几滴CuSO4溶液,气泡生成速率加快 | CuSO4是该反应的催化剂 |
| B | 向5 mL0.1 mol/LKI溶液中滴入0.1 mol/LFeCl3溶液5~6滴,加2 mLCCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象 | 验证Fe3+与I的反应有一定限度 |
| C | 将撒有Na2O2的脱脂棉放在石棉网上,然后向其中滴加少量H2O,观察现象 | 验证Na2O2与H2O反应放热 |
| D | | 验证勒夏特列原理 |
选项 | 实验目的 | 实验及现象 | 结论 |
A | 比较 | 分别测浓度均为 |
|
B | 检验铁锈中是否含有二价铁 | 将铁锈落于浓盐酸,滴入 | 铁绣中含有二价铁 |
C | 探究氢离子浓度对 | 向 | 增大氢离子浓度,转化平衡向生成 |
D | 检验乙醇中是否含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 | 乙醇中含有水 |
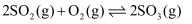 达到了平衡状态,改变某一反应条件,发生下列变化,其中可确定该平衡一定发生移动的是( )
达到了平衡状态,改变某一反应条件,发生下列变化,其中可确定该平衡一定发生移动的是( )
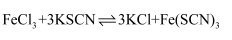 平衡体系中加入少量FeCl3固体,观察溶液颜色变化
平衡体系中加入少量FeCl3固体,观察溶液颜色变化 和
和 的水解常数
的水解常数 的
的 和
和 溶液的
溶液的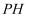 , 后者大于前者
, 后者大于前者
 溶液,紫色褪去
溶液,紫色褪去 、
、 相互转化的影响
相互转化的影响 溶液中缓慢滴加硫酸,黄色变为橙红色
溶液中缓慢滴加硫酸,黄色变为橙红色


