水的电离 知识点题库
 B . 4 ℃时,水的pH=7
C . D216O中,质量数之和是质子数之和的两倍
D . 273 K、101 kPa,2.4L水所含分子数约为6.02×1023
B . 4 ℃时,水的pH=7
C . D216O中,质量数之和是质子数之和的两倍
D . 273 K、101 kPa,2.4L水所含分子数约为6.02×1023
 D .
D . 
 ,某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.对于该溶液,下列叙述不正确的是( )
,某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.对于该溶液,下列叙述不正确的是( )

-
(1) 常温下,已知0.1mol·L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8 , 则溶液的pH=。
①pH=3的HA与pH=l1的NaOH溶液等体积混合;反应的离子方程式为;混合溶液中,各离子的物质的量浓度大小关系是 ;
②0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):c(H+)+ c(HA)- c(OH-)= mol·L-1 。
-
(2) t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=。
①该温度下(t℃),将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=;
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是。


-
(1) 25℃时水的电离平衡曲线应为(选填“A”或“B”);
-
(2) 25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与盐酸溶液的体积比为;
-
(3) 95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是。

 随温度升高而减小
随温度升高而减小
-
(1) 某温度(t℃)时,测得0.01 mol·L-1 NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw= 。
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
-
(2) 25℃时,pH=a的20mL的H2SO4溶液与c(H+)=10-b的200mL的NaOH溶液混合后,溶液呈中性,则a和b满足的关系。
 除
除 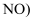 是大气污染防治研究的热点,脱硝过程中涉及的反应为:
是大气污染防治研究的热点,脱硝过程中涉及的反应为: 主反应: 
副反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.5KJ/mol
②4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) △H=-1104.9KJ/mol
③4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1269.0KJ/mol
回答下列问题:
-
(1) 主反应的△H为
-
(2) 如图所示,保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示:
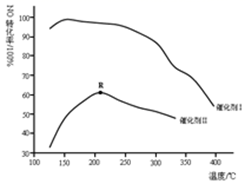
①选用催化剂I的优势有
 写出一点
写出一点 
②R点对应的温度为2100C,低于2100C,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由.
-
(3) 常温下,在通入氧气的条件下用
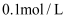 的NaOH溶液吸收NO也可实现脱硝
的NaOH溶液吸收NO也可实现脱硝  产物主要为
产物主要为 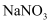 和
和 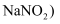 ,已知反应后溶液的
,已知反应后溶液的  ,溶液中
,溶液中  浓度为5.6×10-2mol/L,忽略反应过程中溶液体积变化,
浓度为5.6×10-2mol/L,忽略反应过程中溶液体积变化, 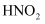 的电离平衡常数为5.1×10-4 , 则:
的电离平衡常数为5.1×10-4 , 则: ①c(NO2-)c(OH-)/c(HNO2)=
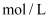
②某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴
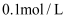 的硝酸银溶液
的硝酸银溶液  一滴为
一滴为 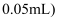 ,通过计算说明能否产生沉淀[Ksp(AgNO2)=2×10-8]
,通过计算说明能否产生沉淀[Ksp(AgNO2)=2×10-8]
|
物质 |
CH3COOH |
NH3·H2O |
HCN |
H2CO3 |
H2A |
|
电离常数(K) |
1.7 × 10−5 |
1.7 × 10−5 |
4.9 × 10−10 |
K1= 4.3× 10−7 K2= 5.6 × 10−11 |
K1= 1 × 106 K2= 1 × 10−2 |
-
(1) 25℃时,将等体积等浓度的醋酸和氨水混合,混合溶液的 pH7(填“>”、“=或“<,该混合溶液中水的电离会受到(填“促进”、“抑制”、“既不促 进也不抑制”)。
-
(2) NaCN 溶液呈性,用离子方程式解释原因。
-
(3) 25.C 时,相同物质的量浓度的下列溶液①CH3 COOH ② NH3·H2O ③NaCN ④Na2CO3 ⑤H2A 中 pH 由大到小的顺序是(填序号)
-
(4) 下列溶液中,分别是由等体积 0.1mol/L 的 2 种溶液混合而成。①NH4Cl 和H2A ②NH4Cl 和 Na2CO3 ③NH4Cl 和 CH3COONa 溶液中 NH3·H2O 浓度由大到小的排列顺序是:。(用序号排列)
-
(5) 写出泡沫灭火器原理(离子方程式)
-
(6) 现有浓度为 0.02mol/L 的 HCN 溶液与 0.01mol/L NaOH 溶液等体积混合之后(忽略混合过程中溶液体积的改变),测得 c(Na+) > c(CN−),下列关系正确的是(____________)A . c(H+) > c(OH−) B . c(HCN) > c(CN−) C . c(H+) + c(HCN) = c(OH−) + c(CN−) D . c(HCN) + c(CN−) = 0.01mol/L
回答下列问题:
-
(1) 4种溶液中水的电离程度最大的是(填序号)。
-
(2) 将4种溶液同等程度稀释10倍后,溶液pH由大到小的顺序是。
-
(3) 若将①④混合后所得溶液中的c(CH3COO-)>c(H+),则下列说法正确的是______(填序号)。A . 溶液一定呈酸性 B . 溶液一定呈碱性 C . 溶液一定呈中性 D . 溶液可能呈酸性、中性或碱性
-
(4) 若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②③ (填“>”“<”或“=”)。
-
(5) 若将②④混合后所得溶液的pH=10,则消耗②和④溶液的体积比:
 =。
=。
-
(1) AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,原因是:(用离子方程式表示)。
-
(2) 把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
-
(3) 常温下pH =12的 Na2CO3溶液中由水电离出的氢氧根离子浓度为 mol/L。
-
(4) 某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=,该温度25℃(填“>”或“<”)。
-
(5) 在(4)所述温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合,若所得混合液为中性,且a=12,b=2,则Va:Vb=。
-
(6) 1mol/L 的Na2CO3溶液中离子浓度由大到小的顺序是。
 ]也随之改变。甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法错误的是( )
]也随之改变。甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法错误的是( ) 
-
(1) 已知:Fe(s)+
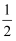 O2(g)= FeO(s) ΔH= -272.0KJ·mol-1
O2(g)= FeO(s) ΔH= -272.0KJ·mol-12Al(s)+
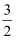 O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1
O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1Al和FeO发热反应的热化学方程式是。
-
(2) 某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断:当反应达到平衡后,其他条件不变,升高温度,反应物的转化率(填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选 填序号)。
A.升高温度 B.增大反应物的浓度
C. 降低温度 D.使用催化剂
-
(3) 1000℃时,硫酸钠与氢气发生下列反应: Na2SO4(s)+4H2(g)= Na2S(s)+ 4H2O(g)。该反应的平衡常数表达式为K=;已知K (1000℃ ) <K (1200℃) ,若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、 “减小”或“不变”)。
-
(4) 常温下,如果取0.1mol·L-1HA溶液与0.1mol ·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH—浓度与0.1mol·L-1NaOH溶液中由水电离出的OH—浓度之比为;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为(填序号)>>
a.NH4Cl b. NH4A c. (NH4)2CO3



