水的电离 知识点
水的电离:水电离出水合氢离子H3O+和OH-,电离方程式简写为:H2O⇋H++OH-。
水的电离 知识点题库
室温下,水的电离达到平衡:H2O⇌ H++OH-。下列叙述正确的是()
A . 将水加热,平衡向正反应方向移动,Kw不变
B . 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C . 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D . 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)=c(H+)
常温下,下列离子能使纯水中的H+离子数目增加的是( )
A . S2﹣
B . CO32﹣
C . NH4+
D . Br﹣
下列表述中,合理的是( )
A . 将水加热,促进水电离,但Kw不变
B . 把FeCl2的水溶液加热蒸干并灼烧后可得到Fe2O3固体
C . 用25 mL碱式滴定管量取20.00 mL高锰酸钾溶液
D . 用水洗净的玻璃棒立即蘸取待测溶液滴到pH试纸中央,半分钟后对照比色卡读出pH值
NaHSO4在水中的电离方程式为常温下,pH=5的NaHSO4溶液中水的电离程度pH=9的NH3•H2O中水的电离程度(填“>”、“=”或“<”)
一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )
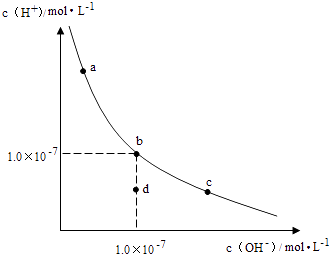
A . 升高温度,可能引起由c向b的变化
B . 该温度下,水的离子积常数为1.0×10﹣13
C . 该温度下,加入FeCl3可能引起由b向a的变化
D . 该温度下,稀释溶液可能引起由c向d的变化
将纯水加热至较高温度,下列叙述正确的是( )
A . 水的离子积变大、pH变小、呈酸性
B . 水的离子积变大、pH变小、呈中性
C . 水的离子积变小、pH变大、呈碱性
D . 水的离子积不变、pH不变、呈中性
如图表示不同温度下水溶液中c(H+)与c(OH﹣)的关系,下列判断正确的是( )
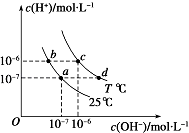
A . 两条曲线上任意点均有c(H+)×c (OH﹣)=Kw
B . T<25
C . b点和c点pH均为6,溶液呈酸性
D . 只采用升温的方式,可由a点变成d点
100℃时,0.01mol/L 的 HCl 溶液中水电离出的 H+的浓度是( )
A . 1×10﹣10 mol/L
B . 1×10﹣2 mol/L
C . 1×10﹣7 mol/L
D . 1×10﹣12 mol/L
25℃时,水的电离达到平衡:H2O⇌H++OH- △H>0,下列叙述正确的是( )
A . 向平衡体系中加入水,平衡正向移动,c (H+)增大
B . 将水加热,Kw增大,pH不变
C . 向水中加入少量硫酸氢钠固体, 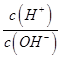 增大
D . 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
增大
D . 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
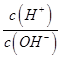 增大
D . 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
增大
D . 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
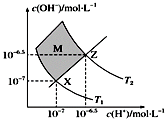
A . 两条曲线间任意点均有c(H+)·c(OH-)=Kw
B . M区域内任意点均有c(H+)<c(OH-)
C . 图中T1<T2
D . XZ线上任意点均有pH=7
下列操作中,能使水的电离平衡向右移动且使液体呈酸性的是( )
A . 向水中加入NaHSO4
B . 向水中加入CuSO4
C . 向水中加入Na2CO3
D . 将水加热到100℃,使pH=6
下列说法正确的是( )
A . HCl溶液中无OH-
B . NaOH溶液中无H+
C . KCl溶液中既无H+也无OH-
D . 常温下,任何物质的水溶液中都有H+和OH- , 且KW=1×10-14
在pH均为9的NaOH和CH3COONa两种溶液中,假设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为:( )
A . A>B
B . A=10-4B
C . B=10-4 A
D . A=B
关于浓度均为0.1mol·L-1的三种溶液:①氨水 ②盐酸③氯化铵溶液,下列说法错误的是( )
A . 溶液的pH:①>③>②
B . 水电离出的(H+):③>②>①
C . ①和②等体积混合后的溶液:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
D . ①和③等体积混合后的溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
最近《科学》杂志评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中正确的是( )
A . 水的离子积仅适用于纯水
B . 水的电离需要通直流电
C . 升高温度水的离子积增大
D . 加入电解质一定会破坏水的电离平衡
如图表示水中c(H+)和c(OH-)的关系。下列判断正确的是( )
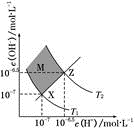
A . 图中T1>T2
B . XZ线上任意点均有pH<7
C . 两条曲线间任意点均有c(H+)×c(OH+)=Kw=1×10-13
D . M区域内任意点对应的溶液中下列离子均可大量共存:S2-、SO42-、Na+、Cl-
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( )
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2
④向水中加入明矾晶体 ⑤向水中加NaHCO3固体 ⑥向水中加NaHSO4固体
A . ④
B . ①④⑤
C . ③④⑤
D . ①②④⑤
常温下,向20mL0.1mol·L-1的CH3COOH溶液中逐滴加入等浓度的NH3·H2O,溶液的pH和溶液中水电离出c(H+)的pH水与滴加NH3·H2O的体积关系如图所示[pH曲线只画了一部分,已知Ka(CH3COOH)=Kb(NH3·H2O)]。
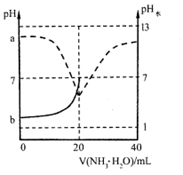
下列说法中正确的是( )
A . a、b两点关于pH=7对称
B . 滴加过程中,c(CH3COO-)逐渐增大
C . V(NH3·H2O)=10mL时,溶液中c(CH3COO-)=c(CH3COOH)
D . V(NH3·H2O)=30mL时,溶液中c(CH3COO-)>c(  )
)
 )
)
在25℃时,下列说法错误的是( )
A . 0.10mol·L-1的HA溶液中  =1010 , 该HA溶液的pH=2
B . pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
C . pH=3的盐酸和pH=3的AlCl3溶液中,水电离出的c(H+)后者大
D . 10mLpH=3盐酸与1mLpH=12NaOH混合后溶液呈中性
=1010 , 该HA溶液的pH=2
B . pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
C . pH=3的盐酸和pH=3的AlCl3溶液中,水电离出的c(H+)后者大
D . 10mLpH=3盐酸与1mLpH=12NaOH混合后溶液呈中性
 =1010 , 该HA溶液的pH=2
B . pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
C . pH=3的盐酸和pH=3的AlCl3溶液中,水电离出的c(H+)后者大
D . 10mLpH=3盐酸与1mLpH=12NaOH混合后溶液呈中性
=1010 , 该HA溶液的pH=2
B . pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
C . pH=3的盐酸和pH=3的AlCl3溶液中,水电离出的c(H+)后者大
D . 10mLpH=3盐酸与1mLpH=12NaOH混合后溶液呈中性
 、
、 、
、 分别表示化学平衡常数、电离常数和水的离子积常数,下列说法正确的是( )
分别表示化学平衡常数、电离常数和水的离子积常数,下列说法正确的是( )
A . 在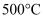 、
、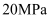 条件下,在密闭容器中进行合成氨的反应,使用催化剂后
条件下,在密闭容器中进行合成氨的反应,使用催化剂后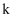 增大
B . 室温下
增大
B . 室温下 , 说明
, 说明 电离产生的
电离产生的 一定比
一定比 电离产生的
电离产生的 大
C .
大
C . 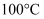 时,
时,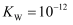 , 此温度下
, 此温度下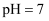 的溶液一定呈中性
D .
的溶液一定呈中性
D .  平衡后,改变某一条件时
平衡后,改变某一条件时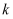 不变,
不变, 的转化率可能增大、减小或不变
的转化率可能增大、减小或不变
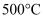 、
、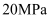 条件下,在密闭容器中进行合成氨的反应,使用催化剂后
条件下,在密闭容器中进行合成氨的反应,使用催化剂后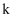 增大
B . 室温下
增大
B . 室温下 , 说明
, 说明 电离产生的
电离产生的 一定比
一定比 电离产生的
电离产生的 大
C .
大
C . 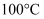 时,
时,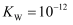 , 此温度下
, 此温度下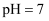 的溶液一定呈中性
D .
的溶液一定呈中性
D .  平衡后,改变某一条件时
平衡后,改变某一条件时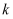 不变,
不变, 的转化率可能增大、减小或不变
的转化率可能增大、减小或不变
最近更新



