探究沉淀溶解 知识点题库
选项 | 实验操作和现象 | 结论 |
A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
B | 向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
C | 室温下,用pH试纸测得:0.1 mol·L-1Na2CO3溶液的pH约为11;0.1 mol·L-1NaHCO3溶液的pH约为8。 | HCO3-结合H+的能力比CO32-的强 |
D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程: Fe3++Ag |
序号 | 甲 | 乙 | 丙 |
① | CO2 | SO2 | 石灰水 |
② | Cl2 | CO2 | CaCl2 |
③ | CO2 | SO2 | Ba(NO3)2 |
④ | NO2 | SO2 | BaCl2 |
⑤ | CO2 | NH3 | CaCl2 |

回答下列问题:
-
(1) 钼酸铵的化学式为(NH4)2MoO4 , 其中Mo的化合价为.
-
(2) 利用联合浸出除杂时,氢氟酸可除去的杂质化学式为如改用FeCl3溶液氧化浸出,CuFeS2杂质的浸出效果更好,写出氧化浸出时发生的化学反应方程式。
-
(3) 加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)MoS4],写出(NH4)2MoS4与盐酸生成MoS3沉淀的离子反应方程式。
-
(4) 由下图分析产生三硫化钼沉淀的流程中应选择的最优温度和时间是。

利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因:。
-
(5) 高纯MoS2中3然会存在极微量杂质,如非整比晶体MoS2.8 , 则该杂质中Mo4+与Mo6+的物质的量之比为。
-
(6) 已知Ksp(BaSO4) =1.1×10-10 , Ksp(BaMoO4)=4.0×10-8),钼酸钠品体( NaMoO4·2H2O) 是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMoO4开始沉淀时,溶液中的c(MoO42-)/c(SO42-)(结果保留2位有效数字)

已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3- , 且存在[Ag(SO3)2]3-  Ag++2SO32-。
Ag++2SO32-。
-
(1) ①“分铜”时,单质铜发生反应的化学方程式为;反应过程中需控制适当温度,温度不宜过高或过低的原因为。
②已知“分铜”时 各元素的浸出率如下表所示。
Cu
Au
Ag
浸出率/%
85.7
0
4.5
“分铜”时加入足量的NaCl的主要作用为
-
(2) “分金”时,单质金发生反应的离子方程式为。
-
(3) “沉银”时,需加入硫酸调节溶液的pH=4。已知:
 ,其中X表示SO32-、HSO3-或H2SO3 , δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3 , δ(x)与PH的关系如图所示。 
①分析能够析出AgCl的原因为
②调节溶液的pH不能过低,理由为
-
(4) “沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为(用离子方程式表示)。
-
(5) 已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为。 (忽略溶液体积变化)
实验目的 | 实验操作或现象 | |
A | 证明AgI的Ksp小于AgCl的Ksp | 向两份相同的银氨溶液中分别滴加2滴等浓度的NaCl和NaI溶液,一份中产生黄色沉淀,另一份无明显现象 |
B | 除去CO2中少量的SO2 | 将混合气体通过饱和Na2CO3溶液 |
C | 证明溶液中含有Fe2+ | 向某溶液中先滴加氯水,再滴加少量KSCN溶液,溶液变成血红色 |
D | 清洗用KMnO4制备O2的试管中残留的MnO2 | 用稀盐酸清洗并用酒精灯加热试管 |

已知:
①“水浸过滤”后的溶液中存在Na2CrO4、NaAlO2等物
②除去滤渣II后,溶液中存在反应2CrO42- +2H+  Cr2O72-+ H2O
Cr2O72-+ H2O
③Na2Cr2O7、Na2CrO4在不同温度下的溶解度(g/100 g H2O)如下表:

-
(1) “焙烧”过程中生成NaAlO2的化学方程式为。
-
(2) 生成滤渣时,需加入适量稀硫酸调节溶液的pH除去AlO2- , 若稀硫酸过量,则因过量引起反应的离子方程式为。
-
(3) “系列操作”为:继续加入稀硫酸、、冷却结晶、过滤。继续加入稀硫酸的目的是;滤渣III中除含有少量硫酸钠晶体外,主要成分是 (写化学式)。
-
(4) 工业上还可以在“水浸过滤”后的溶液中加入适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为。
-
(5) 流程图最后的“滤液”中仍然有残留的Na2Cr2O7。Cr 为重金属元素,若含量过高就排入河流中,会对河水造成重金属污染。为测定“滤液”中的c(Na2Cr2O7),某实验小组取“滤液”20 mL,加水稀釋至250 mL,再取稀释后的溶液25 mL于锥形瓶中,用c mol/L'的FeSO4溶液进行氧化还原滴定,到终点时清耗FeSO4溶液体积为V mL[已知发生的反应为Na2Cr2O7+FeSO4+H2SO4→Na2SO4+Cr2(SO4)3+ Fe2(SO4)3+ H2O(未配平)],则“滤液”中的c(Na2Cr2O7)=mol/L。
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-被还原为NH3 |
B | 將Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液 | 溶液变成红色 | Fe(NO3)2样品中一定含有Fe3+ |
C | 向浓度均为0.1mol/L的Na2CO3和Na2S混合溶液中滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S) > Ksp(Ag2CO3) |
D | 向KI溶液中加入少量苯,然后加入FeCl3溶液 | 有机层呈橙红色 | 还原性Fe2+>I- |

已知:I.铍、铝元素化学性质相似
II.常温下:Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=-2.1×10-13
-
(1) 滤液A的主要成分除NaOH外,还有 (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式。
-
(2) ①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2 , 选择最合理步骤顺序。
a.加入过量的NaOH b.通入过量的CO2 c.加入过量的氨水d.加入适量的HCl e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是。
-
(3) ①MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS 发生反应的化学方程式。
②若用浓HNO3溶解金属硫化物,缺点是(任写一条)。
-
(4) 溶液D中含c(Cu2+)=2.2mol/L、c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是 (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于。
 ,
,  ,
,  。
。 
下列说法正确的是( )
 C . t℃时,向XCO3悬浊液中加入饱和
C . t℃时,向XCO3悬浊液中加入饱和  溶液,可能有YCO3生成
D . t℃时,向饱和YCO3溶液中加入Na2CO3溶液,一定能产生YCO3沉淀
溶液,可能有YCO3生成
D . t℃时,向饱和YCO3溶液中加入Na2CO3溶液,一定能产生YCO3沉淀
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10−16 | 2.2×10−20 | 4.0×10−38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
|
化学式 |
HA(A代表某种酸根) |
HNO2 |
H2CO3 |
|
Ka |
Ka=4.9´10-10 |
Ka=4.6´10-4 |
Ka1=4.1´10-7 Ka2=5.6´10-11 |
-
(1) 用离子方程式表示NaNO2溶液呈碱性的原因。
-
(2) NaHCO3的电离方程式是。
-
(3) A-、CO
 、HCO
、HCO  在水中结合H+的能力由大到小的顺序为。
在水中结合H+的能力由大到小的顺序为。
-
(4) 写出NaA溶液中通少量CO2的离子方程式。
-
(5) 某同学用Na2CO3和NaHCO3溶液进行如下图所示实验。

①充分反应后a试管中大量存在的离子是。
②用离子方程式表示b试管中发生的反应。
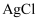 沉淀向
沉淀向  沉淀转化过程中发生了异常现象,便进一步探究原因:
沉淀转化过程中发生了异常现象,便进一步探究原因: 
-
(1) 已知
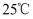 时,
时, 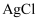 的溶度积
的溶度积  ,则下列说法正确的是___________。
A . 温度一定,当溶液中
,则下列说法正确的是___________。
A . 温度一定,当溶液中 时,此溶液为
时,此溶液为 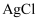 的饱和溶液
B .
的饱和溶液
B .  溶液与
溶液与  溶液混合后的溶液中,一定有
溶液混合后的溶液中,一定有  C . 向饱和
C . 向饱和 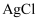 水溶液中加入盐酸,
水溶液中加入盐酸,  值变大
D .
值变大
D . 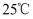 时,与水中相比,
时,与水中相比, 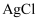 在
在  溶液中的溶解度、
溶液中的溶解度、  均要小
均要小
-
(2) 写出
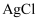 沉淀向
沉淀向  沉淀转化的离子方程式:。
沉淀转化的离子方程式:。
-
(3) 该小组同学认为长时间放置后产生乳白色沉淀与空气中的氧气有关,其反应的化学方程式为:
 □
□  □
□  (请在答题卷的方框中填入物质及计量数) 。
(请在答题卷的方框中填入物质及计量数) 。
-
(4) 为避免
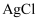 沉淀向
沉淀向  沉淀转化过程中出现异常现象,需控制的反应条件是。
沉淀转化过程中出现异常现象,需控制的反应条件是。
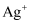 与单质s的反应。
与单质s的反应。资料: 不溶于
不溶于 盐酸,
盐酸, 和
和 在
在 盐酸中均发生沉淀的转化
盐酸中均发生沉淀的转化
实验Ⅰ 将10mL 
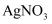 溶液与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
溶液与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
-
(1) 研究黑色固体b的组成
①根据S具有性,推测b中可能含有
 、Ag、
、Ag、 或
或 。
。②检验黑色固体b的成分
实验Ⅱ 具体操作如图所示

ⅰ.取少量滤液c,先加入足量稀盐酸,再滴加
 溶液,未出现白色沉淀,判断黑色固体b中不含。
溶液,未出现白色沉淀,判断黑色固体b中不含。ⅱ.用滤液c继续实验证明了黑色固体b中不含
 , 可选择的试剂是(填序号)。
, 可选择的试剂是(填序号)。a.酸性
 溶液 b.
溶液 b. 和
和 的混合溶液 c.溴水
的混合溶液 c.溴水ⅲ.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有
 , 写出同时生成Ag和
, 写出同时生成Ag和 的离子方程式:。
的离子方程式:。 -
(2) 研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在
 或
或 , 依据是。
, 依据是。实验Ⅲ 具体操作如图所示

①说明溶液a中不含
 的实验证据是。
的实验证据是。②加入足量稀盐酸的作用是。
-
(3) 在注射器中进行实验Ⅳ,探究
 溶液与S的反应,所得产物与实验Ⅰ相同。
溶液与S的反应,所得产物与实验Ⅰ相同。①向注射器中加入的物质是。
②改用
 溶液的目的是。
溶液的目的是。 -
(4) 用
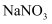 溶液与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中
溶液与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中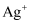 与S反应的离子方程式并简要说明
与S反应的离子方程式并简要说明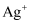 的作用:。
的作用:。

下列说法错误的是( )
 Fe2++Ag+ , 且溶解度AgCl<Ag2SO4
Fe2++Ag+ , 且溶解度AgCl<Ag2SO4


