原电池工作原理及应用 知识点
原电池工作原理:原电池利用氧化还原反应的实质电子转移,将电子转移由直接变为间接,电子从负极出来经过导线流到正极,当电子定向移动时形成了电流,即将化学能转化成了电能。
原电池的应用:通过原电池给用电器提供电能,如南孚电池,铅蓄电池,汽车和电动车的电瓶等,还可利用原电池保护某些金属。
原电池的应用:通过原电池给用电器提供电能,如南孚电池,铅蓄电池,汽车和电动车的电瓶等,还可利用原电池保护某些金属。
原电池工作原理及应用 知识点题库
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 1﹣己醇的沸点比己烷的沸点高 | 1﹣己醇和己烷可通过蒸馏初步分离 |
B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
C | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
D | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
A . A
B . B
C . C
D . D
将锌棒和铜棒按图示方式插入CuSO4溶液中,电流计指针发生偏转,下列针对该装置的说法正确的是( )

A . 该装置是将电能转化为化学能
B . 锌棒为正极
C . 电子由铜棒流出
D . 该电池总反应为Zn+CuSO4═ZnSO4+Cu
根据如图,判断下列说法中错误的是( )

A . 导线上电子由Ag极流向石墨极
B . 负极电极反应式:Fe3++e﹣═Fe2+
C . 盐桥中阴离子移向AgNO3溶液
D . 总反应为:Fe3++Ag═Fe2++Ag+
下列反应不能设计成原电池的是( )
A . 2CH3OH+3O2→2CO2+4H2O
B . NaOH+HCl=NaCl+H2O
C . Zn+2HCl=ZnCl2+H2↑
D . 4Al+3O2+6H2O=4Al(OH)3
铜~锌原电池,电解质溶液为稀硫酸,当该原电池工作时( )
A . 铜电极上发生氧化反应
B . 铜电极上发生还原反应
C . 电子从铜极经过外电路流向锌极
D . 电解质溶液中H+浓度不变
按下图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示( )
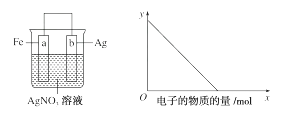
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A . ①③
B . ②④
C . ①③⑤
D . ②④⑥
近年来,尿素电氧化法处理富含尿素的工业废水和生活污水得到了广泛关注,该法具有操作简易、处理量大、运行周期长等优点,且该过程在碱性条件下产生无毒的CO2、N2.电池工作时,下列说法错误的是( )
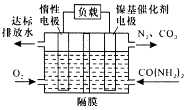
A . 负极发生的反应为: 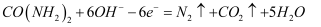 B . 正极附近溶液的pH增大
C . 隔膜只允许阳离子通过
D . 处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)
B . 正极附近溶液的pH增大
C . 隔膜只允许阳离子通过
D . 处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)
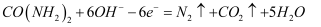 B . 正极附近溶液的pH增大
C . 隔膜只允许阳离子通过
D . 处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)
B . 正极附近溶液的pH增大
C . 隔膜只允许阳离子通过
D . 处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)
如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是( )
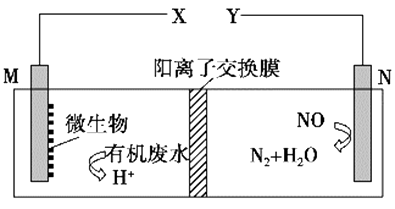
A . 质子透过阳离子交换膜由右向左移动
B . 与X相连接是用电器标有“+”的接线柱
C . M电极反应式:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+
D . 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
乙烯直接氧化法制乙醛的总反应方程式为2CH2=CH2+O2  2CH3CHO。现有人将该反应设计成如图所示的燃料电池,下列有关说法正确的是( )
2CH3CHO。现有人将该反应设计成如图所示的燃料电池,下列有关说法正确的是( )
 2CH3CHO。现有人将该反应设计成如图所示的燃料电池,下列有关说法正确的是( )
2CH3CHO。现有人将该反应设计成如图所示的燃料电池,下列有关说法正确的是( )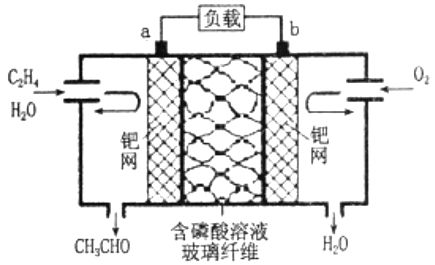
A . a为负极,发生还原反应
B . 电子移动方向:电极a→磷酸溶液→电极b
C . 放电时,电路中每转移0.4mol电子,溶液中就有0.4molH+向负极迁移
D . 该电池负极反应式为CH2=CH2+H2O-2eˉ=CH3CHO+2H+
新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示。下列说法正确的是( )
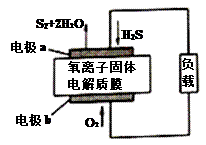
A . 电极b为电池负极
B . 电路中每流过4mol电子,正极消耗44.8LH2S
C . 电极b上的电极反应为:O2+4e-+4H+=2H2O
D . 电极a上的电极反应为:2H2S+2O2--4e-=S2+2H2O
用如图所示装置研究电化学腐蚀及防护。关于I和II的叙述正确的是( )

A . 负极反应均是Fe-2e → Fe2+
B . 正极反应均是O2+2H2O+4e → 4OH-
C . 均是化学能转变为电能
D . 铁均被保护
中科院某课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法中正确是( )
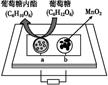
A . a极为正极
B . 随着反应不断进行,负极区的pH不断增大
C . b极电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D . 消耗0.01mol葡萄糖,电路中转移0.02mol电子
热激活电池(又称热电池)可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水 LiCl−KCl 混合物一旦受热熔融,电池瞬间即可输出电能。该电池总反应为:PbSO4 + 2LiCl + Ca = CaCl2 + Li2SO4 + Pb。关于该电池的下列说法中,错误的是( )
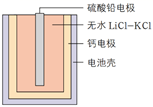
A . 负极的电极反应:Ca−2e- = Ca2+
B . 放电时,K+向硫酸铅电极移动
C . 硫酸铅作正极材料,LiCl为正极反应物
D . 常温时,在正负极之间连上检流计,指针不偏转
下列叙述正确的是( )
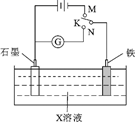
A . K与N连接时,X为硫酸,一段时间后溶液的pH减小
B . K与N连接时,X为氯化钠,石墨电极的电势更高
C . K与M连接时,X为硫酸,一段时间后溶液的pH增大
D . K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-=2H2O+O2↑
如图所示的装置中,下列说法中正确的是( )
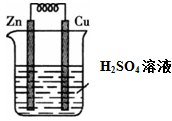
A . 铜片上有气泡产生
B . 铜片溶解
C . 锌极为正极
D . 该装置实现了电能转变为化学能
下列说法正确的是( )
A . 明矾常用作净水剂,是因为明矾具有杀菌消毒的功能
B . 从碘水中萃取碘,可以选择裂化汽油作萃取剂
C . “酸雨”“臭氧层空洞”“光化学烟雾”都可能与氮氧化物有关
D . 在海轮外壳上嵌入钠块,可减缓船体的腐蚀速率
硫含量是生铁质量的重要指标,精确测定铁水中硫含量是高炉炼铁过程中的重要任务,利用硫化物固体电解质浓差电池定硫工作原理如图所示,电池两边产生一定硫分压差时,两极会产生相应的电势,若已知某硫分压(p's2),测定其电池电势,则可通过公式计算得出另一硫分压(p"s2),从而确定铁水中的硫含量,N电极反应为S2(p"s2)+2Mg2++4e-=2MgS。下列有关该浓差电池说法正确的是( )
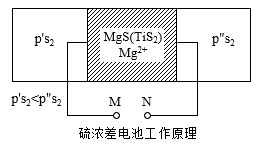
A . M极电势比N极电势高
B . 该电池为电解池
C . M极上的电极反应式:2MgS-4e-=2Mg2++S2(p"s2)
D . Mg2+从左向右移动
回答下列问题:
-
(1) 炒菜的铸铁锅长期不用时会因腐蚀而出现红褐色锈斑,铁锅的锈蚀主要是电化学腐蚀中的腐蚀,正极的电极反应式为。
-
(2) 锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备和交通工具的常用电池。一种锂离子电池构造如图所示,其中电解质
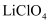 溶于混合有机溶剂中,
溶于混合有机溶剂中,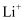 通过电解质迁移入
通过电解质迁移入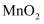 晶格中,生成
晶格中,生成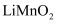 。回答下列问题:
。回答下列问题: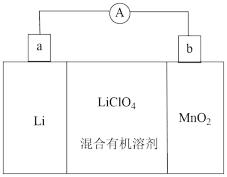
①a电极为该电池的极;
②该电池正极的电极反应式为。
-
(3) 许多有机化学反应包含电子的转移,使这些反应在电解池中进行时称为电有机合成。
电有机合成反应条件温和,生产效率高。电解合成1,
 二氯乙烷
二氯乙烷 的实验装置如图所示。回答下列问题:
的实验装置如图所示。回答下列问题:
①离子交换膜X为交换膜(填“阳离子”或“阴离子”);
②阴极区的电极反应式是;
③阳极区发生的液相反应化学方程式为。
全球变暖是人类行为造成地球气候变化的后果,随着石油、煤炭、木材等含“碳”自然资源的过度使用,导致地球暖化的“元凶”二氧化碳也制造得越来越多,减少二氧化碳排放刻不容缓。回答下列问题:
-
(1) 二氧化碳可催化加氢以制备甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(l)。已知氢气的燃烧热为285.8kJ/mol,甲醇(液态)的燃烧热为725.8kJ/mol,1mol液态甲醇转变为气态需吸热35.5kJ,计算以上甲醇制备反应的ΔH=。
CH3OH(g)+H2O(l)。已知氢气的燃烧热为285.8kJ/mol,甲醇(液态)的燃烧热为725.8kJ/mol,1mol液态甲醇转变为气态需吸热35.5kJ,计算以上甲醇制备反应的ΔH=。
-
(2) 当二氧化碳和氢气起始投料比n(CO2):n(H2)=1:2时,在0.5MPa、2.5MPa、5MPa压强下,H2.的平衡转化率α随温度变化如图所示:
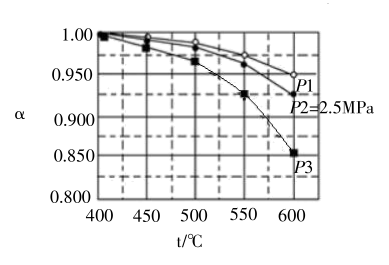
则反应在0.5MPa,550℃时的α=,判断的依据是,影响α的因素有(答出一点即可)。
-
(3) 将组成(物质的量分数)为0.2mol CO2(g),0.6mol H2(g)和0.1mol N2(g)通入反应器,按(1)中的反应原理,在温度T,恒定压强为p的条件下反应,平衡时若H2的转化率为50%,则CH3OH(g)的压强为,平衡常数Kp=(以分压表示,分压=总压×气体物质的量分数)。
-
(4) 根据相关文献报道,我国科学家设计了CO2熔盐捕获与电化学转化装置,原理如下图所示:

则b为电源极(填“正”或“负"),电路中转移0.4mol电子可捕获CO2的体积(标况下)为L。
氢气是未来最具有前途的能源之一、氢气不仅能将二氧化碳转化为 等液体燃料,也能用于燃料电池发电。
等液体燃料,也能用于燃料电池发电。
 等液体燃料,也能用于燃料电池发电。
等液体燃料,也能用于燃料电池发电。
-
(1) 以
 、
、 为原料制
为原料制 涉及的主要反应如下:
涉及的主要反应如下:i.
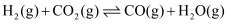
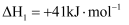
ii.
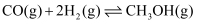
①
 分子中含有键(填“极性”或“非极性”)。
分子中含有键(填“极性”或“非极性”)。②
 、
、 转化为
转化为 、
、 的热化学方程式为。
的热化学方程式为。 -
(2) 在催化剂作用下,反应温度和压强对
 平衡转化率、
平衡转化率、 选择性影响如下图所示。[
选择性影响如下图所示。[ 的选择性
的选择性 ]
]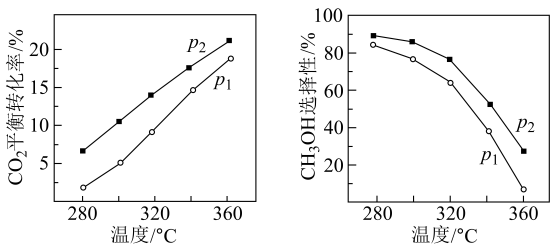
①比较
 、
、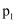 的大小:。
的大小:。②随着温度的升高,
 平衡转化率增大,
平衡转化率增大, 选择性减小。说明原因:。
选择性减小。说明原因:。 -
(3) 氢氧燃料电池是最具发展前途的发电技术之一、设计简单氢氧燃料电池,示意如下:
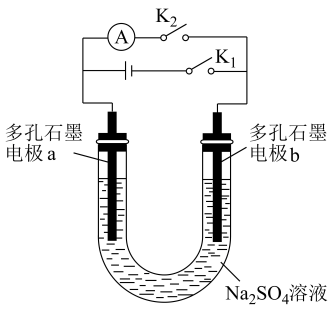
①闭合
 , 一段时间后断开
, 一段时间后断开 。闭合
。闭合 , 电极b发生的电极反应式为。
, 电极b发生的电极反应式为。②不选用
 溶液做电解质溶液的原因是。
溶液做电解质溶液的原因是。 -
(4) 大规模制
 所需能量可由太阳能提供。利用
所需能量可由太阳能提供。利用 可将太阳能储存,释放,结合方程式说明储存、释放太阳能的原理:。
可将太阳能储存,释放,结合方程式说明储存、释放太阳能的原理:。
最近更新



