原电池工作原理及应用 知识点题库






请回答下列问题:
-
(1) 图中甲池是(填“原电池”“电解池”或“电镀池”).
-
(2) A(石墨)电极的名称是 (填“正极”“负极”“阴极”或“阳极”).
-
(3) 写出通入CH3OH的电极的电极反应式
-
(4) 乙池中反应的化学方程式为当乙池中B(Ag)极质量增加5.4g,甲池中理论上消耗O2的体积为 L(标准状况),此时丙池中某电极析出1.6g某金属,则丙池中的某盐溶液可能是
A.MgSO4B.CuSO4 C.NaCl D.AgNO3 .
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
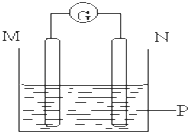
 稀硫酸
B .
稀硫酸
B .  Cu2SO4溶液
C .
Cu2SO4溶液
C .  酒精溶液
D .
酒精溶液
D .  稀硫酸
稀硫酸

-
(1) 已知下列两个热化学方程式:
C3H8(g)+5O2(g)
=3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1H2O(l)
=H2O(g) ΔH=+44.0 kJ·mol-1则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为。
-
(2) 已知:TiO2(s)+2Cl2(g)
2C(s)+O2(g)
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
-
(3) 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示
 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN  N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出kJ能量。
-
(4) 阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2→2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将能转化为能。其电极反应式分别为:负极,正极。

 ,且x+y+z=1,充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6 , 其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是( )
,且x+y+z=1,充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6 , 其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是( ) 


 +2Fe2+=2Fe3++2
+2Fe2+=2Fe3++2  D . Li+选择性透过膜可以通过Li+和H2O
D . Li+选择性透过膜可以通过Li+和H2O
-
(1) Ⅰ.认真观察下图,回答问题:


图中所示反应是(填“吸热”或“放热”)反应。
-
(2) 已知拆开1mol H—H键、1mol Cl—Cl、1mol H—Cl键分别需要吸收的能量为436kJ、243kJ、431kJ,则由1mol氢气和1mol 氯气反应生成2mol HCl会 (填“放出”或“吸收”)kJ的热量。
-
(3) 下列反应中,属于放热反应的是。
① 物质燃烧 ② 炸药爆炸 ③ 煅烧石灰石 ④二氧化碳通过炽热的碳 ⑤ 酸碱中和反应 ⑥ Ba(OH)2·8H2O与NH4Cl晶体反应 ⑦浓硫酸稀释
-
(4) Ⅱ.燃料电池是一种高效供能装置,上右图所示为甲烷燃料工作原理示意图。请回答下列问题:
a电极为电池的(填“正极”或“负极”),电解质溶液中Na+流向极 (填“a”或“b”)。
-
(5) 写出a电极反应式:。
-
(6) Ⅲ.为了检测熟肉中NaNO2含量,某兴趣小组从1000g隔夜熟肉中提取NaNO3和NaNO2后配成溶液,用0.005 mol/L的酸性高锰酸钾溶液滴定。反应原理为:2MnO
 +5NO
+5NO  +6H+=2Mn2++5 NO
+6H+=2Mn2++5 NO  +3H2O。测定三次消耗高锰酸钾溶液平均体积为8.00 mL。则NaNO2含量为mg•Kg-1。
+3H2O。测定三次消耗高锰酸钾溶液平均体积为8.00 mL。则NaNO2含量为mg•Kg-1。

-
(1) X电极为(填“正极”或“负极”),该电极的电极反应式为。
-
(2) 放电过程中,
 向(填“X极”或“Y极”)移动。
向(填“X极”或“Y极”)移动。
-
(3) 若用该燃料电池进行粗铜精炼,则M极连接的是(填“粗铜”或“精铜”),N极的电极反应式为。
-
(4) 若用该燃料电池进行电镀铜,则N极连接的是(填“镀件”或“精铜”),理论上每消耗
 甲烷时,M极变化(增加或减少)的质量为g。
甲烷时,M极变化(增加或减少)的质量为g。
-
(1) 用图甲、乙所示装置进行实验,请回答下列问题:

①以下叙述中,正确的是。
a.甲中锌片是负极,乙中铜片是正极 b.两烧杯中铜片表面均有气泡产生
c.两烧杯中溶液的pH均增大 d.乙中电流由铜片经过导线流向锌片
②若反应过程中有0.4mol电子转移,乙装置中生成的氢气在标况下的体积为。
-
(2) Mg,Al设计成如由图所示原电池装置:

①若溶液为盐酸,Mg为极;
②若溶液为氢氧化钠溶液,Mg电极发生的电极反应为。
-
(3) CO与
 反应还可制备
反应还可制备 ,
,  可作为燃料使用,用
可作为燃料使用,用 和
和 组合形成的质子交换膜燃料电池的结构示意图如下:
组合形成的质子交换膜燃料电池的结构示意图如下:
电池总反应为
 , 则c电极的反应方程式为,若线路中转移2mol电子,则上述
, 则c电极的反应方程式为,若线路中转移2mol电子,则上述 燃料电池,消耗的
燃料电池,消耗的 在标准状况下的体积为L。
在标准状况下的体积为L。

-
(1) 写出二甲醚一种同分异构体的结构简式:。
-
(2) 已知:4.6g二甲醚气体完全燃烧生成液态水放出 145.5kJ 热量,写出其燃烧的热化学反应方程式。
-
(3) 工业上可用水煤气合成二甲醚:2CO(g) + 4H2(g)⇌CH3OCH3(g) + H2O(g)
①测得 CO 和 CH3OCH3(g)的浓度随时间变化如图所示,则反应开始至平衡时的 H2平均反应速率v(H2)= mol/(L·min )。

②该反应在恒容密闭容器中进行,下列叙述中能表示该反应达到平衡状态的是。
A.单位时间内生成 CO 和 H2的物质的量之比为 1﹕2
B.CH3OCH3的浓度不再变化
C.容器内压强不再变化
D.CH3OCH3 与 H2O 的物质的量相等
-
(4) 二甲醚燃料电池工作原理如图所示
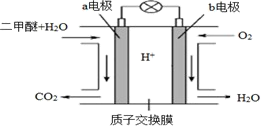
①该电池的负极是 (填“a 电极”或“b 电极”)
②H+通过质子交换膜时的移动方向是。(填选项字母)
A.从左向右 B.从右向左
③通入 O2的电极反应式是。



