乙醇的工业制法 知识点题库
乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:

回答下列问题:
(1)A的结构简式为 。
(2)B的化学名称是 。
(3)由乙醇生产C的化学反应类型为 。
(4)E是一种常见的塑料,其化学名称是 。
(5)由乙醇生成F的化学方程式为 。
①羧基(﹣COOH) ②醛基 (﹣CHO) ③羟基 (﹣OH)
(2)发酵法制乙醇的过程可简略表示如下:
(C6H10O5)n+nH2O  nC6H12O6
nC6H12O6
C6H12O6; 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
上述反应中C6H12O6的名称是 ,实验室中常用 或氢氧化铜悬浊液来检验.

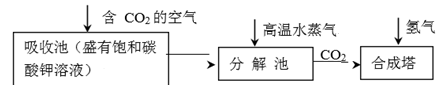
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇.回答下列问题:
-
(1) 写出吸收池中反应的离子方程式
-
(2) 从分解池中循环使用的物质是
-
(3) 在一定压强下,测得由CO2制取CH3CH2OH的实验数据如表:

500
600
700
800
1.5
45
33
20
12
2.0
60
43
28
15
3.0
83
62
37
22
提高氢碳n(H2)/n(CO2)比,对生成乙醇 (选填“不利”、“有利”或“无影响”).

-
(1) 米酒中乙醇含量可采用蒸馏法测定,装置如图Ⅰ所示.仪器A的名称是 ;A中温度计的位置正确的是 (选填a、b或c);
-
(2) 收集乙醇的锥形瓶需置于冰水浴中,其目的是 .欲收集无水乙醇,可加入足量的 (填物质名称)后再进行蒸馏.
-
(3) 为测定某白酒样品的总酸量,取20.00mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010mol/L的NaOH标准溶液滴定至终点.判断终点的依据是 .若该白酒样品为优质级,则消耗NaOH溶液体积应不小于 mL.
-
(4) 白酒中的总酯量可用返滴法测定.往上题滴定后的溶液(恰好至终点)中再加入20.00mL 0.100mol/L NaOH标准溶液,用图Ⅱ装置水浴加热半小时.冷却后用0.100mol/L的硫酸标准溶液滴定至终点.加热半小时的目的是 .已知最终消耗硫酸标准溶液7.70mL,该白酒样品中总酯量为 g/L.
-
(5) 下列操作会使总酯量测定结果偏高的是 (选填编号)
a.加热时未使用水浴和冷凝管
b.选用了甲基橙为指示剂
c.滴定前滴定管内无气泡,滴定后产生气泡
d.滴定管未用硫酸标准溶液润洗
-
(6) 图Ⅰ和图Ⅱ的装置中均用到了冷凝管,其进水口分别为 (选填编号)
a.①③b.②④c.②③d.①④
 CH3CH2OH
B . 制盐酸:H2+Cl2
CH3CH2OH
B . 制盐酸:H2+Cl2 2 HCl
C . 制烧碱:2NaCl+2H2O
2 HCl
C . 制烧碱:2NaCl+2H2O  2 NaOH+H2↑+Cl2↑
D . 湿法冶炼铜:Fe+CuSO4=Cu+FeSO4
2 NaOH+H2↑+Cl2↑
D . 湿法冶炼铜:Fe+CuSO4=Cu+FeSO4
②CH3CH2Br与氢氧化钠水溶液共热③(C6H10O5)n(淀粉)+nH2O→nC6H12O6(葡萄糖) C6H12O6(葡萄糖)→2C2H5OH+2CO2↑.
-
(1) 方法①的化学反应方程式是.
-
(2) 方法②的化学反应类型是.
-
(3) 为缓解石油短缺带来的能源危机,你认为该市应选用哪一种方法生产工业酒精?,请简述理由:.
-
(4) 如果从绿色化学(“原子利用率”最大化)的角度看,制酒精最好的一组方法是A . ① B . ③ C . ①③ D . ②③ E . ①②③
-
(1) 乙醇是无色有特殊香味的液体,密度比水。
-
(2) 工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为
(不写反应条件),原子利用率是。
-
(3) 属于乙醇的同分异构体的是(选填编号)。

-
(4) 乙醇能够发生氧化反应:
①46 g乙醇完全燃烧消耗mol氧气。
②乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为

-
(1) 能够发生加成反应的烃有种。
-
(2) 与A互为同系物的是(填字母)。
-
(3) 工业上可用有机物C来合成乙醇,写出该反应的化学方程式:。
-
(4) 烯烃在一定条件下被氧化时,由于
 断裂,转化为醛或酮。如:
断裂,转化为醛或酮。如: 
某有机物H与上述有机物C互为同系物,其所含碳原子数是有机物C的4倍,发生上述类似条件的反应时只有一种产物,且该产物不能发生银镜反应,写出该产物的结构简式: 。
资料1:乙醇分子有两个末端,一端是憎水(易溶于油)的—C2H5;一端是亲水(易溶于水)的—OH。
资料2:破坏蛋白质分子中形成蜷曲和螺旋的各种力,使长链舒展、松弛,可导致蛋白质变性。
资料3:水分子可以松弛蛋白质外部亲水基团之间的吸引力,而-OH不能;—C2H5可以破坏蛋白质内部憎水基团之间的吸引力。
-
(1) 乙醇的结构及性质
①1mol乙醇分子中的极性共价键有mol。
②从结构角度解释乙醇的沸点比乙烷高的原因 。
-
(2) 乙醇的用途
①医用酒精(75%)制备过程与制酒的过程类似,不能饮用,但可接触人体医用。

结合题中资料,下列说法正确的是(填字母)。
a.糖化、发酵的过程均含有化学变化
b.获得医用酒精常采用的分离提纯方法是蒸馏
c.浓度99%的酒精消毒杀菌效果一定大于75%的酒精
②乙醇是一种很好的溶剂,在油脂的皂化反应中,加入乙醇可加快反应速率,其原因是 。
-
(3) 乙醇的工业制取
乙醇的工业制取方法很多,由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙
醇的工艺流程。
该流程中能循环使用的物质是。
| 实验目的 | 实验设计 | |
| A | 检验溶液中 | 取少量待测液,滴加 |
| B | 净化实验室制备的 | 气体依次通过盛有饱和 |
| C | 测定 | 将待测液滴在湿润的pH试纸上,与标准比色卡对照 |
| D | 工业酒精制备无水乙醇 | 工业酒精中加生石灰,蒸馏 |
-
(1) 甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象。请在表中将实验现象及结论补充完全。
实验现象
实验结论
①
钠沉在烧杯底部
钠的密度乙醇(填“大于”或“小于”)
②
反应有气体产生
-
(2) 乙同学探究了乙醇的催化氧化反应,反应装置如图。实验操作流程为:点燃酒精灯,加热片刻后,再间歇性地挤压气囊鼓入空气。

①反应时
 中铜丝的颜色变化为。
中铜丝的颜色变化为。②一段时间后
 中收集到一种新物质,写出生成该物质的化学方程式,该实验说明乙醇具有性(填“氧化”或“还原”)。
中收集到一种新物质,写出生成该物质的化学方程式,该实验说明乙醇具有性(填“氧化”或“还原”)。 -
(3) 丙同学根据教材中制备乙酸乙酯的实验装置图进行了改进,如图,继续实验。

乙醇
乙酸
乙酸乙酯
98%浓硫酸
熔点/℃

16.6

——
沸点/℃
78.5
117.9
77.5
338.0
资料:温度高于140℃时发生副反应:

①水从冷凝管的 (填“
 ”或“
”或“ ”)处进入。
”)处进入。②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是 (填字母)。
A.
 B.
B. C.
C.
-
(4) 用30g乙酸与46g乙醇反应,如果实际产量是理论产量的67%,则实际得到乙酸乙酯的质量是g。
-
(1) 正丁烷与异丁烷互为同分异构体的依据是。
-
(2) 乙烯与
 加成,乙烯使酸性
加成,乙烯使酸性 溶液褪色的原因是,工业上制取乙醇的化学方程式是。
溶液褪色的原因是,工业上制取乙醇的化学方程式是。
-
(3) 将下端绕成螺旋状的铜丝在酒精灯外焰上灼烧,铜丝表面会变黑。反应的化学方程式为;将表面变黑的铜丝灼烧后立即插入盛有无水乙醇的试管中,可以看到乙醇沸腾,铜丝表面恢复红亮。反应的化学方程式为;上述实验操作反复几次后,可以闻到有刺激性气味的物质生成。反应的总的化学方程式为。铜是该反应的,原因是。
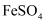 是否被氧化
是否被氧化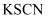 溶液,观察溶液颜色变化
溶液,观察溶液颜色变化
 溶液、浓
溶液、浓  的洗气瓶
的洗气瓶 溶液的pH
溶液的pH


