酯化实验 知识点题库
①CH3CO*OH和C2H5OH
②CH3COOH和C2H5*OH
③CH3C*OOH和C2H5OH
④CH3CO*OH和C2H5*OH.
①加入0.5mL乙醛溶液;②加入10%的氢氧化钠溶液2mL;③加入2%的CuSO4溶液4﹣5滴;④加热试管.正确的顺序是 .
(2)实验室配制少量银氨溶液的方法:先向试管中加入 ,然后 ,其反应的离子方程式为 ,向银氨溶液中滴加少量乙醛, ,片刻即可在试管内壁形成银镜,化学方程式为
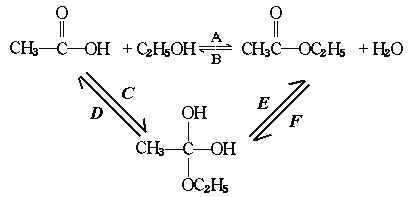
即酯化反应实质是经过中间体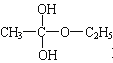 再转化为酯和水,以上反应均为可逆反应,回答下列问题:
再转化为酯和水,以上反应均为可逆反应,回答下列问题:
-
(1) 用
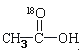 进行该实验,18O可存在于哪些物质中
A . 乙酸 B . 乙醇 C . 乙酸乙酯 D . 水
进行该实验,18O可存在于哪些物质中
A . 乙酸 B . 乙醇 C . 乙酸乙酯 D . 水 -
(2) 若用CH3﹣CH2﹣18O﹣H进行该实验,18O可存在于哪些物质中A . 乙酸 B . 乙醇 C . 乙酸乙酯 D . 水
-
(3) 请分别指出A~F反应属于取代反应的有 ,属于加成反应的有
 2CH3CHO+2DHO
C . 二氧化硫、氨、煤的液化均为物理变化
D . 实验室中制取乙酸乙酯的方程式为CH3COOH+H18O﹣C2H5CH3COOC2H5+H218O
2CH3CHO+2DHO
C . 二氧化硫、氨、煤的液化均为物理变化
D . 实验室中制取乙酸乙酯的方程式为CH3COOH+H18O﹣C2H5CH3COOC2H5+H218O
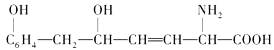 ,下列叙述中不正确的是( )
,下列叙述中不正确的是( )
选项 | 工艺 | 叙述 |
A | 谷 物 酿 酒 | 陈酿酒散发浓香是因为发生了酯化反应 |
B | 烧制陶瓷 | 涉及反应的方程式为CaCO3+SiO2=CaSiO3+CO2↑ |
C | 铸造钱币 | 钱币久置生锈变绿,铜绿的主要成分为Cu2(OH)2CO3 |
D | 配置火药 | 火药主要成分是硝酸钾、木炭和硫磺,点燃后生成的气体有2种 |
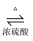 CH3COOCH2CH3+H2O
B . 2CH3COOH+Mg = (CH3COO)2Mg+H2↑
C . CH4+Cl2
CH3COOCH2CH3+H2O
B . 2CH3COOH+Mg = (CH3COO)2Mg+H2↑
C . CH4+Cl2  CH3Cl+HCl
D .
CH3Cl+HCl
D . 
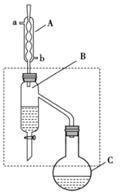
| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
下列说法正确的是( )
![]()
下列关于聚丙烯酸酯的说法错误的是( )
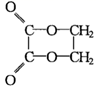 )的正确顺序是( )
)的正确顺序是( )
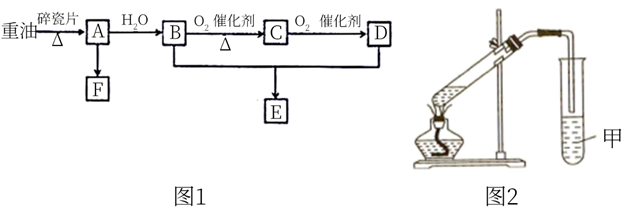
-
(1) A的分子式是,A转化成B的反应类型是。
-
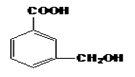
(2) B分子中的官能团名称是;鉴别B和D可选用的试剂是(填符合题意选项的字母编号)。
A.
 溶液 B.酸性
溶液 B.酸性  溶液 C.蒸馏水
溶液 C.蒸馏水 -
(3) F是一种高分子材料,其名称是,结构简式为。
-
(4) B生成C的化学方程式是。
-
(5) 现用3.0gD与4.6gB制取E,其装置如图2所示。甲试管盛有滴加了酚酞的饱和
 溶液。
溶液。 ①实验中
 溶液的作用是吸收乙醇、中和、降低乙酸乙酯的溶解度,利于其分层析出。
溶液的作用是吸收乙醇、中和、降低乙酸乙酯的溶解度,利于其分层析出。②实验结束后,观察到试管中上层为透明、不溶于水的油状液体。但仔细对比,甲试管溶液的颜色比实验前要浅一些,你认为可能的原因是。
③若实验中乙酸乙酯的产率为67%,则实际得到的乙酸乙酯的质量为g(结果保留两位小数)。
 , 依次加入过量的NaOH、Na2CO3、BaCl2溶液
C . 用铁片、石墨作为电极代替铜锌原电池中的锌片、铜片,也能产生电流
D . 制备乙酸乙酯的实验中,向试管中先加入乙醇,后边振荡试管边慢慢加入浓硫酸和乙酸,并将产生的蒸气通到饱和碳酸钠溶液的液面上
, 依次加入过量的NaOH、Na2CO3、BaCl2溶液
C . 用铁片、石墨作为电极代替铜锌原电池中的锌片、铜片,也能产生电流
D . 制备乙酸乙酯的实验中,向试管中先加入乙醇,后边振荡试管边慢慢加入浓硫酸和乙酸,并将产生的蒸气通到饱和碳酸钠溶液的液面上
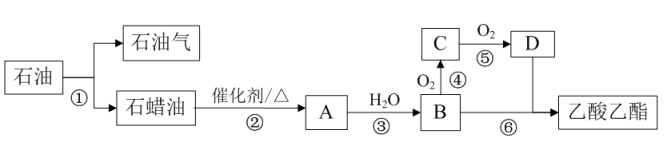
-
(1) 过程②这种获得有机化工原料的方法在工业上叫做。物质D中含有的官能团名称为。过程③发生的反应类型是。
-
(2) 石油气的成分中含有一种电子总数为42的烷烃,该烷烃共有种同分异构体,其中一氯代物共有4种的名称是。
-
(3) 以淀粉为原料经水解生成葡萄糖,葡萄糖在酒化酶的作用下可分解生成B,写出生成B的化学方程式。实验室实现过程④反应的化学方程式为。
-
(4) 实验室常用下列装置实现过程⑥发生的化学反应。
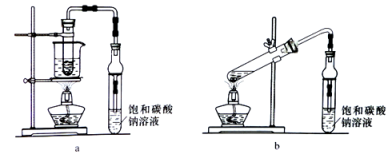
①实验时,先在大试管中加入B、浓硫酸、D的混合物,再加入。
②反应结束后,将收集到的产品倒入分液漏斗中振荡、静置、分液,从分液漏斗上口倒出。
③相对于a装置,用b装置进行制备的缺点有(答一条即可)。



