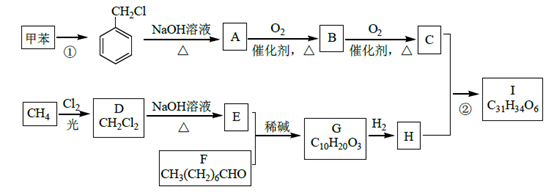
合成有机高分子化合物的性质实验 知识点题库
咖啡酸苯乙酯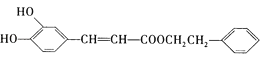 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化:
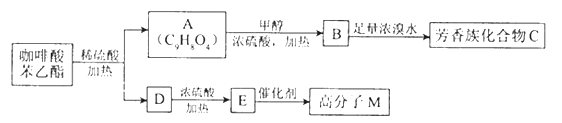
请填写下列空白.
-
(1) D分子中的官能团是 ;高分子M的结构简式是
-
(2) 写出A→B反应的化学方程式:
-
(3) B→C发生的反应类型有
-
(4) A的同分异构体很多种,其中,同时符合下列条件的同分异构体有 种.
①苯环上只有两个取代基;②能发生银镜反应;③能与碳酸氢钠溶液反应;④能与氯化铁溶液发生显色反应.
-
(5) 以下对A具有的性质描述正确的是
a.1molA可消耗2molNaOH
b.一定条件下1molA最多能与1mol氢气加成
c.能发生银镜反应
d.能发生取代反应.
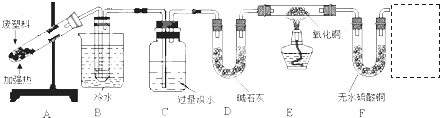
实验课题 | 探究废旧塑料热分解的主要产物为多种烃的混合物 |
查阅资料 | ①CuO能将烃氧化成CO2和H2O ②甲苯可被酸性KMnO4溶液氧化为甲酸,苯甲酸能溶于苯 |
实验设计 |
|
实验记录 | 按如图连接装置,隔绝空气强热装置A中的试管(忽略装置内空气的影响)一段时间后,可观察到如下现象: ①B装置试管中有液态物质生成 ②C中溴水的颜色变浅 ③E中黑色氧化铜变红 ④F中无水硫酸铜变蓝 |
试根据上表回答下列问题:
-
(1) 写出一定条件下制备聚丙烯化学方程式.
-
(2) 经分析得知装置B试管中的液态产物是甲苯和苯的混合物.设计实验除去其中含有的甲苯.
-
(3) 实验中装置C的作用是.
-
(4) 若没有装置D,对实验结论产生的影响是.
-
(5) 有同学认为“E中黑色氧化铜变红,F中无水硫酸铜变蓝”是废旧聚丙烯塑料热分解产物中含氢气导致的.请你在F装置后增加一个实验装置,以确认使CuO变红是气态烃,而不是氢气,画出增加的装置图(要注明其中盛放的试剂名称)
⑤CH2=CH—CH=CH2 , 其中可用于合成 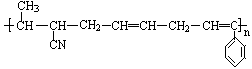 高分子材料的正确组合为( )
高分子材料的正确组合为( )
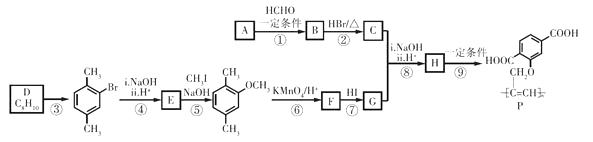
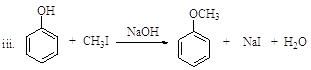
已知: ![]() (R、R’表示氢或烃基)
(R、R’表示氢或烃基)
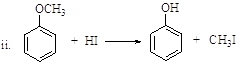
-
(1) 烃A的相对分子质量是26,其结构简式是。
-
(2) 反应①的反应类型是。
-
(3) C中含有的官能团是。
-
(4) D为苯的同系物,反应③的化学方程式是。
-
(5) G的结构简式是。
-
(6) 反应⑨的化学方程式是。
-
(7) 反应⑤和⑦的目的是。
-
(8) 以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
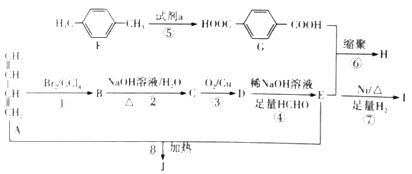
已知:① 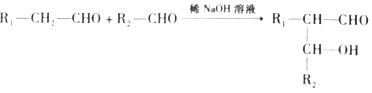
② 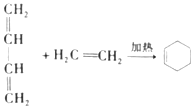
③有机物B的分子式为C4H6Br2 , 其核磁共振氢谱有2组峰,且峰面积之比为1:2。
请回答下列问题
-
(1) 有机物F的名称是,反应⑤利用试剂a的哪种性质? 填“氧化性”或“还原性”)。
-
(2) 高聚物H的结构简式为,已知J中含有一个六元环,则J的结构简式为。
-
(3) D→E的化学方程式为,反应类型为。
-
(4) 1mol的E生成I最多可以消耗molH2 , B和C的相对分子质量的差值为。
-
(5) C的同分异构体中满足下列条件的有种。
①可以发生银镜反应 ②可以与金属钠反应产生氢气
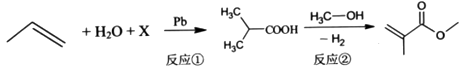 (MMA)
(MMA)
下列说法正确的是( )
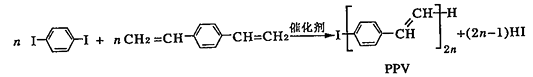
下列说法正确的是( )
-
(1) A的结构简式为,B中官能团的电子式为,D中官能团的名称为。
-
(2) 反应①的反应类型是,反应③的化学方程式为:。
-
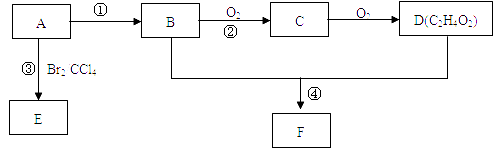
(3) 反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次,观察到的现象是。该反应的化学方程式为。
-
(4) D与碳酸氢钠溶液反应的离子方程式为。
-
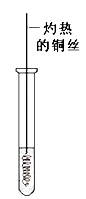
(5) B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
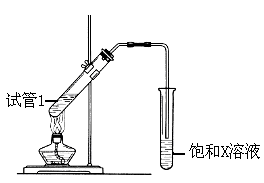
图中X的化学式为。浓硫酸的作用是。
该反应的化学方程式为。
注:甲苯、苯甲醛、苯甲酸三者互溶; 酸性: 苯甲酸>醋酸
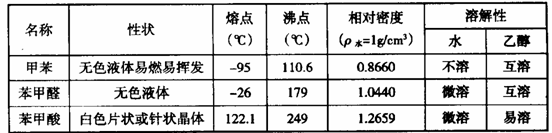
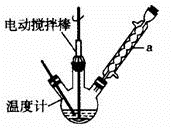
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
-
(1) 装置a的名称是,主要作用是,为使反应体系受热比较均匀,可采取的加热方式是。
-
(2) 三颈瓶中发生反应的化学方程式为。
-
(3) 写出苯甲醛与银氨溶液发生反应的化学方程式 。
-
(4) 反应完毕后,反应混合液经过自然冷却至室温时,还应经过、(填操作名称)等操作,才能得到苯甲醛粗产品。
-
(5) 实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥 c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合振荡
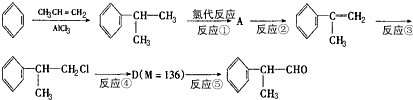
-
(1) 在合成路线上①~⑤反应中,属于消去反应的为(填反应序号)。
-
(2) 写出反应④的化学方程式:。
-
(3) 在一定条件下,D与有机物X发生酯化反应生成E(M =164),则X的结构简式为。
写出满足下述两个条件的E的两种同分异构体的结构简式:
a.能与NaHCO3反应产生气体 b.苯环上的一氯取代物只有一种结构,
-
(4) 氢化阿托醛被氧化后的含氧官能团的名称是。
-
(5) 1mol氢化阿托醛最多可和mol氢气加成。
-
(6) 由
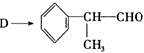 反应的化学方程式为
反应的化学方程式为
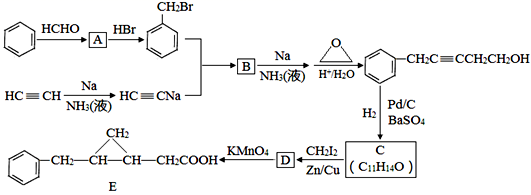
回答下列问题:
-
(1) 以下有关苯和乙炔的认识正确的是。
a.苯和乙炔都能使溴水褪色,前者为化学变化,后者为物理变化
b.苯和乙炔在空气中燃烧都有浓烟产生
c.苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯
d.聚乙炔是一种有导电特性的高分子化合物
-
(2) A的名称。
-
(3) 生成B的化学方程式为,反应类型是。
-
(4) C的结构简式为,C的分子中一定共面的碳原子最多有个。
-
(5) 与D同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有4种,请写出其中2种同分异构体的结构简式:。
已知:a. 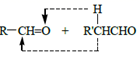

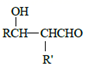
b. 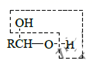
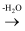 RCHO
RCHO
c.E是甲醛
回答下列问题:
-
(1) 反应①所需试剂、条件分别是;F 的化学名称为。
-
(2) ②的反应类型是;A→B 的化学方程式为。
-
(3) G 的结构简式为;H 中所含官能团的名称是。
-
(4) 化合物W 的相对分子质量比化合物C 大14,且满足下列条件,W的可能结构有种。其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式。
①遇FeCl3溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应
-
(5) 设计用甲苯和乙醛为原料制备
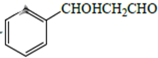 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A  B---
B---  目标产物)
目标产物)
反应原理: 
相关物质的相对分子质量及部分物理性质:
| 相对原子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| CH3CH2OH | 46 | -114.1 | 78.3 | 与水互溶 |
| CCl3CHO | 147.5 | -57.5 | 97.8 | 可溶于水、乙醇 |
| CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
回答下列问题:
-
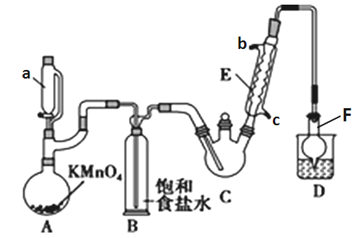
(1) 仪器 a 的名称是 ,往 a 中加入盐酸,将其缓慢加入到高锰酸钾中,反应的化学方程式: 。
-
(2) 装置 D 的作用是 ,仪器 F 的作用是 ,E 中冷凝水应从 (填“b”或“c”)口进。
-
(3) 反应过程中若存在次氯酸,CCl3CHO 可能被氧化为 CCl3COOH,写出 CCl3CHO 被次氯酸氧化的化学反应方程式:。
-
(4) 该设计流程存在一处缺陷导致副产物增多,请提出改进的措施: 。
-
(5) 测定产品纯度:称取产品 0.36g 配成待测溶液,加入 0.1000mol·L-1碘标准溶液20.00mL,再加入适量 Na2CO3溶液,反应完全后加盐酸调节溶液的 pH,立即用0.0200mol·L-1 Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗溶液 20.00mL。则产品的纯度为 (计算结果保留三位有效数字)。(

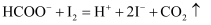 ;
; 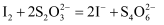 )
)
-
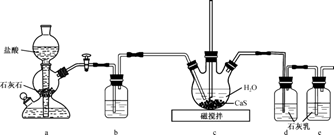
(1) 制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为 ;装置b中盛放的试剂是 。
②装置c中的长直导管的作用是。
-
(2) 制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是;该反应的化学方程式为。
-
(3) 探究硫脲的性质:①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是(填化学式,下同)
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 。
③可用酸性KMnO4溶液滴定硫脲,已知MnO
 被还原为Mn2+ , CS(NH2)2被反应为CO2、N2及SO
被还原为Mn2+ , CS(NH2)2被反应为CO2、N2及SO  , 该反应中氧化剂与还原剂的物质的量之比为。
, 该反应中氧化剂与还原剂的物质的量之比为。

-
(1)
 的名称是,
的名称是, 中所含官能团名称为,
中所含官能团名称为,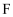 的分子式为。
的分子式为。
-
(2)
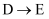 、
、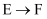 的反应类型分别是、。
的反应类型分别是、。
-
(3) 一定条件下,
 可以氧化为
可以氧化为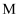 :
: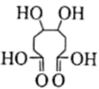 ,
, 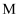 发生酯化反应可以形成分子内含有两个五元环的酯,该酯化反应的化学方程式为。
发生酯化反应可以形成分子内含有两个五元环的酯,该酯化反应的化学方程式为。
-
(4)
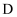 的同分异构体有很多种,写出同时满足下列条件的结构简式。
的同分异构体有很多种,写出同时满足下列条件的结构简式。①与
 溶液反应显紫色 ②
溶液反应显紫色 ②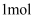 该物质最多消耗
该物质最多消耗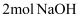
③核磁共振氢谱有4组峰,且峰面积比为
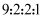
-
(5) 参照题中的合成路线并结合所学知识,以
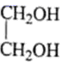 、
、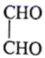 和
和 为主要原料,设计
为主要原料,设计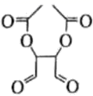 的合成路线。(其他无机试剂任选)
的合成路线。(其他无机试剂任选)
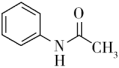 )具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺可通过苯胺(
)具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺可通过苯胺(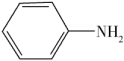 )和乙酸反应制得,该反应是放热的可逆反应。
)和乙酸反应制得,该反应是放热的可逆反应。
已知:I.苯胺在空气中易被氧化。
II.可能用到的有关性质如下:
|
名称 |
相对分子质量 |
性状 |
密度g/cm3 |
熔点/℃ |
沸点/℃ |
溶解度 |
|
|
g/100水 |
g/100g乙醇 |
||||||
|
苯胺 |
93 |
棕黄色油状液体 |
1.02 |
-6.3 |
184 |
微溶 |
∞ |
|
冰醋酸 |
60 |
无色透明液体 |
1.05 |
16.6 |
117.9 |
∞ |
∞ |
|
乙酰苯胺 |
135 |
无色片状晶体 |
1.21 |
155~156 |
280~290 |
温度高,溶解度大 |
较水中大 |
I.制备乙酰苯胺的实验步骤如下:
步骤1:在制备装置加入9.2 mL苯胺、17.4 mL冰醋酸、0.1 g锌粉及少量水。
步骤2:小火加热回流1 h。
步骤3:待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250 mL冷水的烧杯中,乙酰苯胺晶体析出。冷却,减压过滤(抽滤),制得粗乙酰苯胺。
II.乙酰苯胺的提纯
将上述制得的粗乙酰苯胺固体移人500 mL烧杯中,加入100 mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5 min,趁热过滤。待滤液冷却至室温,有晶体析出,称量产品为10.8 g。
回答下列问题:
-
(1) 写出制备乙酰苯胺的化学方程式。
-
(2) 将三种试剂混合时,最后加入的试剂是。
-
(3) 步骤2:小火加热回流1 h,装置如图所示。a处使用的仪器为 (填“A”、“B”或“C”),该仪器的名称是。
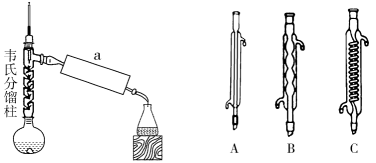
-
(4) 步骤I反应体系的温度控制在100℃~105℃,目的是。
-
(5) 步骤II中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是。这种提纯乙酰苯胺的方法叫。
-
(6) 乙酰苯胺的产率是 (精确到小数点后1位),导致实际值低于理论值的原因不可能是 (填字母标号)。
A.没有等充分冷却就开始过滤 B.在抽滤时,有产物残留在烧杯壁
C.乙酰苯胺中的乙酸未除干净 D.抽滤时乙酰苯胺有部分溶于水中