常用仪器及其使用 知识点题库
 蒸发皿
D .
蒸发皿
D .  B .
B . A.把制得的溶液小心地转移至容量瓶中。
B.在天平上称取14.2g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水将它完全溶解并冷却至室温。
C.继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
-
(1) 操作步骤的正确顺序为(填序号)。
-
(2) 本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、玻璃棒,还缺少的必要仪器是。
-
(3) 下列情况中,会使所配溶液浓度偏高的是___________(填序号)。A . 某同学观察液面时俯视 B . 没有进行上述的操作步骤D C . 加蒸馏水时,不慎超过了刻度线 D . 容量瓶使用前内壁沾有水珠
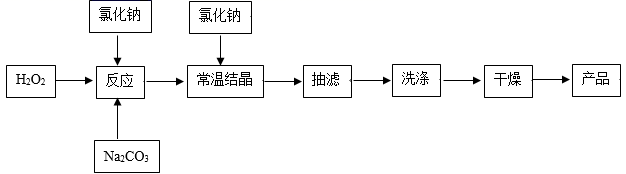
-
(1) 该流程中氯化钠的作用是。
-
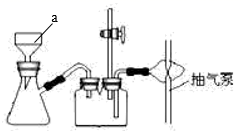
(2) “抽滤” 操作如图所示,仪器 a 的名称 ,抽滤时,用玻璃纤维替代滤纸的原因是。
-
(3) 下列操作或描述错误的是_____________A . 制备过碳酸钠时加稳定剂的作用是防止双氧水分解 B . 采用热水洗涤可提高除杂效果 C . 洗涤时,应使洗涤剂快速通过沉淀 D . 为加快干燥速度,产品可在真空干燥器中干燥
-
(4) 为测定过碳酸钠的化学式,某化学兴趣小组准确称取0.3140g 样品溶于水配成待测液,用如图装置进行实验,选出实验正确的操作并排序:(选项可重复选择或不选)检查装置气密性→ → → →
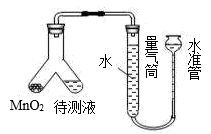
a.将MnO2转移到待测液中
b.将待测液转移到MnO2 中
c.调整量气管和水准管的液面相平,记录刻度
d.静置一段时间使气体冷却
e.如图在 Y 型管中装入MnO2 和待测液
-
(5) 由(4) 中实验测得产生氧气的体积为36.75mL, 已知该温度下气体摩尔体积为24.5L•mo1-1 , 则过碳酸钠的化学式为。
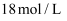 的浓硫酸准确配制
的浓硫酸准确配制  的稀硫酸,下列哪种仪器不是必须使用的( )
的稀硫酸,下列哪种仪器不是必须使用的( )
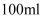 容量瓶
B . 胶头滴管
C . 托盘天平
D . 量筒
容量瓶
B . 胶头滴管
C . 托盘天平
D . 量筒
回答下列问题:
-
(1) NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制Cl2 , Cu和稀HNO3制NO。
①制取NO的离子方程式为
②选用下列部分装置预制备一瓶干燥纯净的氯气,各玻璃导管接口连接顺序为(气流方向从左至右)。

-
(2) 文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的原理及装置如下所示:
反应原理:NaNO2+2HCl=NOCl↑+NaCl+H2O。制取装置图:
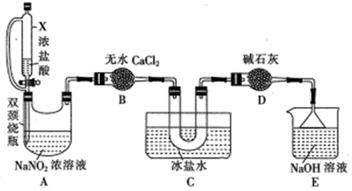
①仪器X的名称为,用它代替分液漏斗的优点是
②装置C的U形管中观察到的现象是,装置D的作用是
-
(3) 取少量产品NOCl滴入盛有水的试管中,液面上方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为
-
(1) Ⅰ.酸碱中和滴定
选择酚酞作指示剂,用标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:

已知:国家标准规定酿造白醋中醋酸含量不得低于
 。
。①滴定达到终点时的现象是滴入半滴标准NaOH溶液后。
②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为mL。

③已知实验所用标准NaOH溶液的浓度为
 , 根据上述滴定结果可知该白醋(填“符合”或“不符合”)国家标准。
, 根据上述滴定结果可知该白醋(填“符合”或“不符合”)国家标准。④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是(填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
-
(2) 若用
 溶液分别滴定体积均为20.00 mL、浓度均为
溶液分别滴定体积均为20.00 mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
①滴定醋酸的曲线是(填“Ⅰ”或“Ⅱ”)。
②
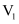 和
和 的关系:
的关系: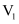
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。③若25℃时,
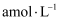 的醋酸与
的醋酸与 的氢氧化钠溶液等体积混合量中性,则醋酸的电离常数为(用含a的代数式表示)。
的氢氧化钠溶液等体积混合量中性,则醋酸的电离常数为(用含a的代数式表示)。 -
(3) Ⅱ.氧化还原滴定
 的纯度(杂质不参与反应)通常利用“间接碘量法”测定。已知:
的纯度(杂质不参与反应)通常利用“间接碘量法”测定。已知: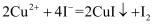
 。步骤如下:
。步骤如下:①称取1.250 g胆矾产品配成100 mL溶液;
②取其中25.00 mL溶液,滴加KI溶液至不再产生沉淀;
③用
 标准溶液滴定,平行滴定3次。
标准溶液滴定,平行滴定3次。若
 标准溶液的平均用量为10.00 mL,则胆矾产品纯度为%。
标准溶液的平均用量为10.00 mL,则胆矾产品纯度为%。
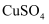 溶液,甲瓶为100mL 1.0mol/L
溶液,甲瓶为100mL 1.0mol/L 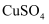 溶液,乙瓶为100g 15%
溶液,乙瓶为100g 15% 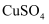 溶液。
溶液。
-
(1) 若将乙瓶溶液的浓度转化为物质的量浓度,还需要的物理量是。
-
(2) 实验室用
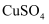 固体配制两种溶液,配制甲瓶溶液比配制乙瓶溶液多出的仪器是。
固体配制两种溶液,配制甲瓶溶液比配制乙瓶溶液多出的仪器是。
-
(3) 配制过程中需要“摇匀”,写出配制甲瓶溶液“摇匀”的具体操作。
-
(4) 配制甲瓶溶液时,未经冷却,直接转移到容量瓶中,所配溶液的浓度将 (填“偏大”“偏小”或“不变”)
-
(5) 实验室制取硫酸铜有以下两种方案:
方案一:
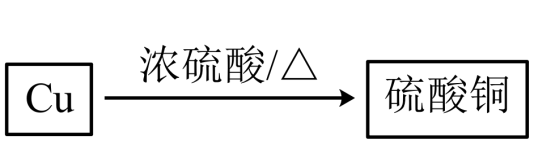
方案二:

上述两种方案中(填“方案一”或“方案二”)更优,理由是。
 B .
B .  C .
C .  D .
D .  、
、 、
、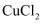 )中回收铜并制备氯化铁晶体,设计流程如图。下列说过法正确的是( )
)中回收铜并制备氯化铁晶体,设计流程如图。下列说过法正确的是( )
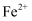

-
(1) 图中有处必要的仪器或用品未画出,它是。
-
(2) 向小烧杯中倒入NaOH溶液的正确操作是(填标号)。
a.沿玻璃棒缓慢倒入
b.分三次少量倒入
c.一次迅速倒入
-
(3) 装置中加隔热层的目的是。
-
(4) 该同学实验记录的数据如表所示:
实验次数
起始温度/℃
终止温度/℃
温度差/℃
HCl
NaOH
平均值
1
25.5
25.0
25.25
28.63
3.38
2
24.5
24.2
24.35
27.74
3.39
3
25
24.2
24.75
28.15
3.40
表中记录的终止温度是指,根据上表数据计算中和反应的反应热△H=(近似认为实验所用盐酸和NaOH溶液的密度都是1 g•cm-3 , 中和后溶液的比热容c为4.18 J•g-1•℃-1)。
-
(5) 若用1.1 g NaOH固体代替50 mL0.55 mol•L-1的NaOH溶液进行上述实验,放出的热量(填“偏大”“偏小”或“不变”)。




