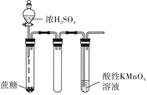
除杂 知识点题库

已知:Cu2O+2H+=Cu+Cu2++H2O
-
(1) 实验操作I的名称为;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有(填仪器名称).
-
(2) 滤液A中存在的阳离子有,固体混合物B经过提纯后可得SiO2 , 写出它的一种用途
-
(3) 金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程为.
-
(4) 常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH﹣)前者为后者的108倍,则两种溶液的pH=.
-
(5) 从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤为:称取一定质量的样品→→过滤、洗涤、干燥→称量剩余固体铜的质量.(填缺少的操作步骤,不必描述操作过程的细节)
-
(6) 利用电解法进行粗铜精炼时,下列叙述正确的是(填代号).
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系.
选项 | 待提纯的物质 | 除杂试剂 | 分离方法 |
A | 乙醇(乙醇钠) | Na | 过滤 |
B | 溴苯(Br2) | 苯 | 萃取 |
C | 苯甲酸(NaCl) | 水 | 重结晶 |
D | 苯(苯酚) | NaOH溶液 | 蒸馏 |
| 物质(杂质) | 除杂试剂或方法 | |
| A | CO2(SO2) | NaOH溶液 |
| B | 汽油(H2O) | 分液 |
| C | FeCl3溶液(FeCl2) | Cl2 |
| D | Na2CO3固体(NaHCO3) | 加热 |

-
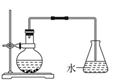
(1) 在装置A中,生成的气体除乙烯外还有乙醚、CO2、SO2等,则生成乙烯的化学方程式为,河沙的作用是。仪器a的名称为。
-
(2) 装置B可起到安全瓶的作用,若气压过大,该装置中出现的现象为。
-
(3) 装置C可除去CO2、SO2 , 所盛放的溶液为。
-
(4) 装置D中进行的主要反应的化学方程式为;把试管置于盛有冰水的小烧杯中的目的是。

-
(1) B的化学式。
-
(2) 加过量A的原因是,有关反应的化学方程式为;。
-
(3) 加过量B的原因是,有关反应的化学方程式为;。

-
(1) Na、Na2O、Na2O2、NaOH久置空气中最终都是变为(填化学式);
-
(2) Na放在石棉网上加热反应的化学方程式为。
-
(3) Na2O2与CO2反应的化学方程式为。
-
(4) 写出除去下列气体中的杂质(括号内的气体为杂质)所用的试剂,并写出除杂的化学方程式。
CO2(HCl);化学方程式:。
-
(5) 用1L1.0mol·L-1的NaOH溶液吸收0.8molCO2 , 所得溶液Na2CO3中和NaHCO3物质的量浓度之比为。
| 选项 | A | B | C | D |
| 方案 | | | | |
| 目的 | 验证浓硫酸的吸水性和脱水性 | 验证苯和液溴能发生取代反应 | 除去甲烷、乙烯混合气中的乙烯 | 比较乙醇中羟基氢原子和水分子氢原子的活泼性 |
| 选项 | 实验目的 | 操作 |
| A | 检验绿茶中是否含有酚类物质 | 向茶水中滴加FeCl3溶液 |
| B | 区别地沟油与矿物油 | 测定沸点,有固定沸点的是矿物油 |
| C | 除去苯中混有的少量苯酚 | 向苯和苯酚的混合物中滴加浓溴水,过滤 |
| D | 鉴别甲苯、环己烯 | 分别加入酸性高锰酸钾溶液,褪色的是环己烯,不褪色的为甲苯 |

-
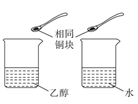
(1) 装置A中还缺少的一种必需实验仪器是。使用冷凝管的目的是。装置A中发生反应主要反应的化学方程式为。
-
(2) 装置B中插人玻璃管的作用是。
-
(3) 实验时若温度控制不好,A中三颈烧瓶内会产生某种刺激性气味的气体,为吸收该气体在装置B中应加入的最佳试剂为。(填字母序号)。
A.高锰酸钾溶液B.浓硫酸C.氢氧化钠溶液D.饱和碳酸氢钠溶液
为检验该气体已完全除去,C中盛放的试剂为。(填试剂名称)。
-
(4) D中a、c两个导气管进入仪器中的长度不同,其优点是。从绿色化学角度考虑,对导气管b的进一步处理方法是。
-
(5) 实验结束后收集得到ag1,2-二氯乙烷,则乙醇的利用率为。
| 选项 | 物质及所含杂质 | 除杂方案 |
| A | Na2CO3(NaHCO3) | 充分灼烧 |
| B | Cu(Zn) | 加入过量稀H2SO4 , 充分反应后过滤、洗涤、干燥 |
| C | MnO2(MnCl2) | 溶解、过滤、洗涤、干燥 |
| D | Cl2(H2O) | 通过碱石灰 |
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 右盘上加2g砝码,左盘上放NaOH固体 |
| B | 除去FeCl3溶液中含有少量的FeCl2杂质 | 向溶液中加入铁粉 |
| C | 检验溶液中是否含有Fe3+ | 取少量试液于试管中,加入KSCN溶液,观察溶液是否呈红色 |
| D | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |

已知:①GeO2、As2O3既能溶于强酸,也能溶于强碱
②GeCl4的熔点为-49.5℃,沸点为83℃,GeCl4容易与AsCl3形成共沸物。
-
(1) Ge在周期表中位于第四周期族。
-
(2) “碱熔”在1000℃下熔炼,GeO2反应的主要化学方程式为。反应后得到的共熔物中含有的阴离子除CO
 、AsO
、AsO 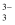 、GeO
、GeO  外,还有 (填离子符号)
外,还有 (填离子符号)
-
(3) “水浸”中,为提高Ge的浸出率,可以采取的措施有(答2条)。
-
(4) “除杂”中,加入 (填“盐酸”、“氨水”、“Al2O3”、“NaOH溶液”),调节溶液pH=10.5,除去Al和Si。
-
(5) 已知H3AsO3和H3AsO4水溶液中含砷的各种微粒的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图:

“除杂”后所得的滤液中含砷粒子浓度最大的是。在“氧化”中,加入适量的NaClO3 , 结合图写出主要反应的离子方程式。充分反应后继续调节溶液pH约为5,分离得到GeO2•nH2O。

-
(6) 已知GeO2•nH2O+4HCl
 GeCl4+(n+2)H2O。在“精馏”中,加入硫酸和7mol/L的盐酸的混酸,硫酸的作用是。
GeCl4+(n+2)H2O。在“精馏”中,加入硫酸和7mol/L的盐酸的混酸,硫酸的作用是。
-
(7) 提取四氯化锗的另一种工艺步骤是:将含锗煤灰用上述混酸的酸浸,过滤后直接蒸馏,这种工艺的缺点是。
选项 | 需除杂的物质 | 试剂 | 操作 |
A | Cl2(H2O) | 碱石灰 | 洗气 |
B | Cl2(HCl) | 饱和食盐水 | 洗气 |
C | NaHCO3(Na2CO3) | —— | 加热 |
D | HNO3溶液(H2SO4) | BaCl2溶液 | 过滤 |
选项 | 物质 | 除杂试剂 | 方法 |
A | 酒精(水) | CaO | 蒸馏 |
B | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
C | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
D | 苯(溴) | KI溶液 | 分液 |