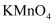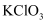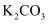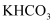化学实验操作的先后顺序 知识点题库
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
-
(1)
- 验证假设一
- 该小组设计实验验证了假设一,请在下表空白处填写相关实验现象
实验步骤
实验现象
结论
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体
假设一成立
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体
-
(2)
为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如下图
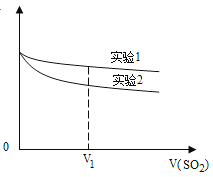
实验1中溶液pH变小的原因是 V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示) 。
-
(3) 验证假设二
请设计实验验证假设二,写出实验步骤,预期现象和结论。
实验步骤、预期现象和结论(不要求写具体操作过程)
-
(4) 若假设二成立,请预测:在相同条件下,分别通入足量的O2和KNO3 , 氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者 (填大于或小于)后者,理由是 。
-
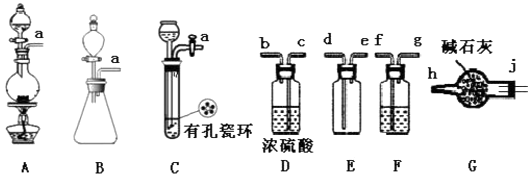
(1) 制备Cl2发生装置可以选用(填写字母代号),请写出发生反应的离子方程式:。
-
(2) 欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→(按气流方向,用小写字母表示)。
-
(3) 实验室可用下图装置制备亚硝酰氯(ClNO):

①实验室也可用B装置制备NO,X装置的优点为。
②检验装置气密性并装入药品,打开K2 , 然后再打开K1 , 通入一段时间气体,其目的为,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中ClNO可能发生反应的化学方程式为。
-
(4) 取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(ClNO)的质量分数为(用代数式表示)。[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10 , Ksp(K2CrO4)=1×10-12]
-
(1) 从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解沉降,③,④,⑤冷却结晶。
-
(2) 用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示________(填字母)。A . 左盘重,样品轻 B . 左盘轻,砝码重 C . 右盘重,砝码轻 D . 右盘轻,样品重
-
(3) 在进行②③④操作时,都要用到玻璃棒,其作用分别是:②;③;④。
-
(4) 将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察有生成,证明溶液中有离子。
②在第二支试管里加入足量稀盐酸后,再加入BaCl2溶液,可观察到有生成,证明溶液中有离子。
③在第三支试管里加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量稀硝酸后,再加入AgNO3溶液,可观察到有生成,证明溶液中有离子。
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将过量的CO2通入CaCl2溶液中 | 无白色沉淀出现 | 生成的Ca(HCO3)2可溶于水 |
| B | 常温下将铁片插入浓硫酸中 | 无明显现象 | 铁片和浓硫酸不反应 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 向澄清石灰水加入某试剂的溶液少许 | 产生白色沉淀 | 该试剂中一定含有CO32— |
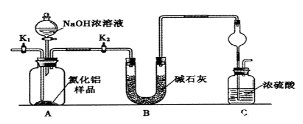
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
-
(1) 如图C装置中球形干燥管的作用是。
-
(2) 完成以下实验步骤:组装好实验装置,首先;再加入实验药品。接下来的实验操作是,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1 , 通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是。
-
(3) 由于装置存在缺陷,导致测定结果偏高,请提出改进意见。
-
(4) (方案2)用如下图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
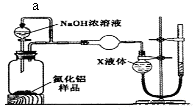
导管a的主要作用是。
-
(5) 为测定生成气体的体积,量气装置中的X液体可以是。(填选项序号)
a.CCl4 b.H2O c.NH4Cl溶液 d.

-
(6) 若mg样品完全反应,测得生成气体的体积为VmL,(已转换为标准状况),则AlN的质量分数为(用含V、m的代数式表示)。
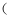 不参与反应
不参与反应  按体积比1:3混合通入含水
按体积比1:3混合通入含水  的碳酸钠中制备Cl2O(同时生成一种使澄清石灰水变浑浊的气体和一种盐),并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。(Cl2在CCl4中的溶解度较大)
的碳酸钠中制备Cl2O(同时生成一种使澄清石灰水变浑浊的气体和一种盐),并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。(Cl2在CCl4中的溶解度较大) 
-
(1) 各装置的连接顺序为


 。
。
-
(2) 装置B中多孔球泡和搅拌棒的作用是;装置C的作用是。
-
(3) B中的化学方程式为。
-
(4) 反应过程中,装置B需放在冷水中,其目的是。

-
(1) 甲组做金属钠在空气中燃烧实验。实验室取用金属钠的方法是。
-
(2) 金属钠燃烧时会生成黑色固体,黑色固体的可能来源是、。
-
(3) 某同学想用金属钠和空气制备纯度较高的Na2O2(不考虑空气中的N2),可利用的装置如图。

①装置Ⅳ中盛放的药品是,若没有该装置可能导致生成的Na2O2中含有,其反应的化学方程式为。
②若规定气流的方向为从左到右,各仪器连接的顺序是空气进入,接,接,接。(填字母)
③装置Ⅱ的作用是。
 制取、收集、吸收,以及
制取、收集、吸收,以及  的还原性探究进行了如下实验设计。
的还原性探究进行了如下实验设计。
-
(1) I.
 的收集和吸收
的收集和吸收 若用图甲装置,排空气法收集
 ,气体应从口进入(选填“A”或“B)。
,气体应从口进入(选填“A”或“B)。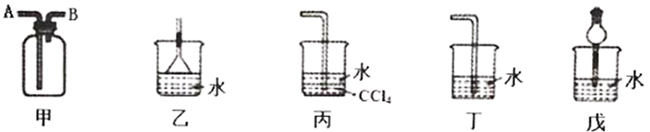
-
(2) 已知
 难溶于
难溶于  。图乙、丙、丁、戊四种装置中,不能用来吸收
。图乙、丙、丁、戊四种装置中,不能用来吸收  的是。
的是。
-
(3) II.
 的还原性探究利用下列装置,进行
的还原性探究利用下列装置,进行  还原
还原  的反应。
的反应。 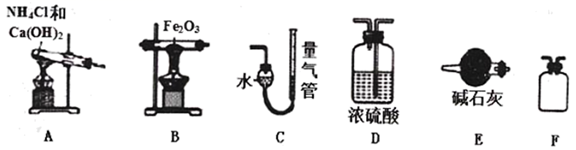
已知:
 与
与  反应的生成物为
反应的生成物为  和难溶于水的气体X,且X不被浓硫酸和碱石灰吸收。
和难溶于水的气体X,且X不被浓硫酸和碱石灰吸收。写出A装置发生反应的化学方程式。
-
(4) 按气流方向正确的装置连接顺序为A→→→→→C(填序号,每个装置只用一次)。
-
(5) 实验结束时,应首先(填序号)。
①熄灭A装置的酒精灯 ②熄灭B装置的酒精灯
-
(6) 若称取1.6克
 完全反应后,测得生成气体X的体积为
完全反应后,测得生成气体X的体积为  (已折算为标准状况),通过计算推测B中
(已折算为标准状况),通过计算推测B中  与
与  反应的化学方程式为。
反应的化学方程式为。
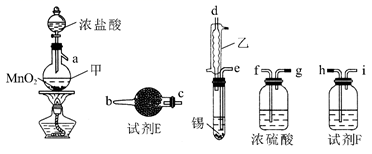
已知:①无水四氯化锡的熔点-33℃、沸点114.1℃;②四氯化锡易水解,易溶于有机溶剂。下列说法正确的是( )
 晶体,流程如下:
晶体,流程如下:

已知:①

②
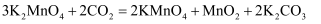
③
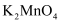 在中性或酸性介质中不稳定,快速发生歧化反应
在中性或酸性介质中不稳定,快速发生歧化反应
④部分物质的溶解性表:
| 温度 溶解度 物质 |
0℃ |
20℃ |
40℃ |
60℃ |
80℃ |
100℃ |
|
|
2.83g |
6.34g |
12.6g |
22.1g |
||
|
|
3.3g |
7.3g |
13.9g |
23.8g |
37.5g |
56.3g |
|
|
105g |
111g |
117g |
127g |
140g |
156g |
|
|
22.5g |
33.7g |
47.5g |
65.6g |
-
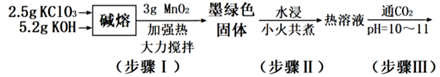
(1) 步骤I实验中所用坩埚是铁坩埚而不用瓷坩埚的原因是:
碱熔氧化过程,KOH的用量要过量,其目的是:
-
(2) 下列说法错误的是:___________A . 步骤I中,
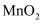 应分批加入,以提高原料利用率;过程中还需用铁棒不断搅拌,以防结块
B . 步骤III中,为使得
应分批加入,以提高原料利用率;过程中还需用铁棒不断搅拌,以防结块
B . 步骤III中,为使得
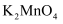 充分歧化,所通入
充分歧化,所通入
 最宜过量至溶液呈弱酸性
C . 步骤III中,为验证
最宜过量至溶液呈弱酸性
C . 步骤III中,为验证
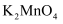 已经完全歧化,可用玻璃棒蘸取溶液于滤纸上,观察滤纸上是否有绿色痕迹
D . 步骤IV中,抽滤时为防止滤纸破损,可选择用双层普通滤纸或直接用砂芯漏斗
E . 步骤V中,经一系列操作获得的
已经完全歧化,可用玻璃棒蘸取溶液于滤纸上,观察滤纸上是否有绿色痕迹
D . 步骤IV中,抽滤时为防止滤纸破损,可选择用双层普通滤纸或直接用砂芯漏斗
E . 步骤V中,经一系列操作获得的
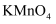 晶体常出现结块现象,应用研钵充分研磨后再密封保存
晶体常出现结块现象,应用研钵充分研磨后再密封保存
-
(3) 步骤V中为获得
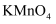 晶体,从下列选选项中选出合理的操作并排序:将滤液转移至蒸发皿中→→→→→干燥。
晶体,从下列选选项中选出合理的操作并排序:将滤液转移至蒸发皿中→→→→→干燥。
a.用少量冰水洗涤
b.先用冰水洗涤,再用乙醇洗涤c.蒸发溶剂至析出大量晶体,趁热过滤
d.缓慢降温结晶
e.减压过滤f.蒸发溶剂至溶液表面析出晶膜
-
(4) 产品纯度分析:取mg所得晶体,溶于水并加入酸酸化,定容至100mL。取25mL溶液于锥形瓶中,用
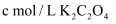 标准溶液进行滴定,消耗标准溶液VmL。
标准溶液进行滴定,消耗标准溶液VmL。
①酸化
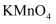 溶液可用代替稀硫酸
溶液可用代替稀硫酸②所得晶体的纯度为:(填写数学表达式,要求化简)

回答下列问题:
-
(1) “煅烧”时,生成CO2和H2O的物质的量之比为。
-
(2) 该小组欲用如图装置验证“煅烧”步骤的气体产物。

①按气流方向,上述装置的连接顺序为(填仪器接口的字母编号),试剂X为。
②该实验中需采用3.00mol•L-1H2O2溶液。欲配制100mL3.00mol·L-1H2O2溶液,需要量取溶质质量分数为34%的H2O2溶液(密度为1.13g·mL-1)的体积为mL(保留两位小数),量取34%的H2O2溶液时所使用的仪器为。
③装置D中石棉的作用为。
-
(3) “还原氯化”时,需要在加热条件下进行,该反应的化学方程式为。
-
(4) “还原氯化”时,加入过量的NH4Cl可有效抑制CeCl3的水解,解释其原因为。
已知:
苯胺 | 乙酸酐 | 冰醋酸 | 乙酰苯胺 |
沸点184℃,稍溶于水,易被氧化而变色。相对分子质量为93 | 沸点139℃,相对分子质量为102 | 沸点117.9℃,相对分子质量为60 | 无色晶体,沸点304℃,难溶于冷水,易溶于乙醇等有机溶剂。相对分子质量为135 |
(一)粗乙酰苯胺的制备
原理: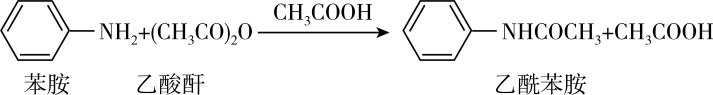
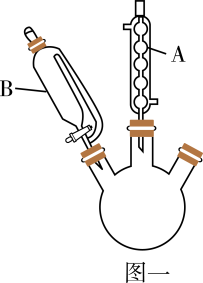
实验装置:如图一所示(夹持装置略)。
实验步骤:将35mL(38g)乙酸酐、37mL(39g)冰醋酸放入三颈烧瓶中,在B中放入25mL(25.5g)苯胺,逐滴滴加到三颈烧瓶中,边滴边振荡,滴加完毕小火加热30min。在搅拌下,趁热把反应混合物慢慢倒入500mL冷水中,析出固体。将混合物抽滤得到乙酰苯胺粗品。
(二)乙酰苯胺的提纯
①将粗乙酰苯胺晶体移入盛有500mL热水的烧杯中,加热至沸,使之溶解。
②稍冷后,加入适量粉末状活性炭,充分搅拌后趁热进行抽滤。
③将滤液转移到干净烧杯中,冷却、抽滤,用少量冷水洗涤、抽滤。
④将产物放在干净的表面皿中晾干、称重,质量为22.5g。
回答下列问题:
-
(1) 图一中装置A的名称是,其作用为。
-
(2) 本实验所用三颈烧瓶的适宜规格为____mL(填标号)。A . 100 B . 250 C . 500
-
(3) 制备粗品过程中将反应混合物倒入冷水中,目的是。
-
(4) “提纯”步骤②中加入活性炭的作用是。
-
(5) 用图二装置进行“提纯”步骤③中的抽滤和洗涤过程。请按正确的操作顺序补充完整(只进行一次洗涤操作):打开抽气泵→转移混合物至布氏漏斗→关闭活塞K→确认抽干→打开活塞K→→→确认抽干→打开活塞K→关闭抽气泵。本实验多次用到抽滤操作,其优点是。
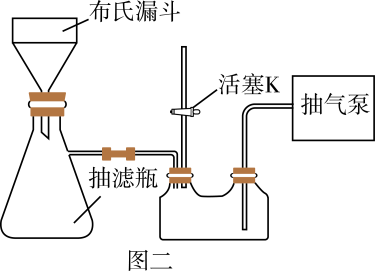
-
(6) 本实验的产率为%(保留三位有效数字)。若要得到纯度更高的乙酰苯胺晶体,用于提纯的方法为。
-
(1) I.联氨制备(夹持及加热装置已省略):
①氯气和氨气在丙酮中生成丙酮联氮[(CH3)2C=NN=C(CH3)2]且有白烟生成。
②丙酮联氮水解可得到丙酮和水合肼(N2H4•H2O)。
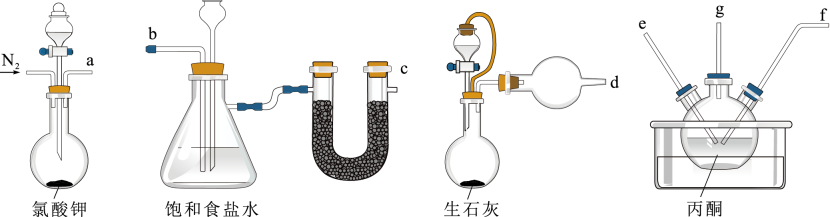
按照接口顺序a→ → → → ←d进行实验,反应前先通入一段时间的氮气排出空气,丙酮中生成丙酮联氮的化学方程式为。
-
(2) 盛放丙酮溶液的仪器名称为,饱和食盐水中长颈漏斗的作用是;反应过程中要控制氯气的通入量不能过量的原因是。
-
(3) 装置存在明显缺陷,g后所接装置图可以是(填标号)。
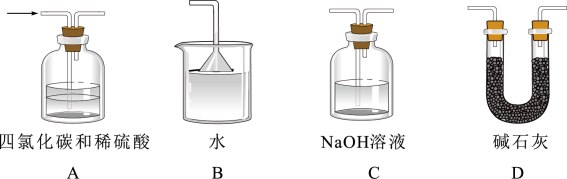
-
(4) II.产品纯度测定:
量取水解液50.0mL加水调至弱碱性,配成250mL溶液,移出25.00mL,再加入足量AgNO3溶液;充分反应后,过滤、洗涤、干燥、称量,得固体质量为0.216g。则水解液中肼的含量为g•L-1。
 与金属钠在高温下反应生成纳米石墨,设计如下装置:
与金属钠在高温下反应生成纳米石墨,设计如下装置: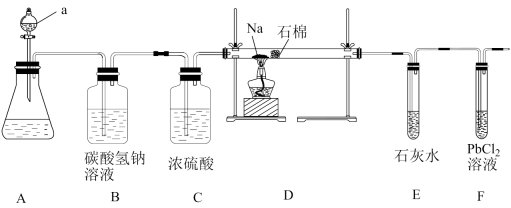
回答下列问题
-
(1) 装置A中的a的仪器名称为。
-
(2) 实验时,在点燃酒精灯前必须进行的操作是。
-
(3) 装置E中出现现象时,再点燃酒精灯,以上操作的目的是。
-
(4) 待装置D加热一段时间后观察到钠块表面变黑,继续加热后,钠燃烧,有白烟生成。取残留固体溶于水,发现有黑色的不溶颗粒存在;取上层液体与过量的
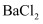 溶液反应发现有白色沉淀生成,根据以上信息,写出装置D中的反应方程式。
溶液反应发现有白色沉淀生成,根据以上信息,写出装置D中的反应方程式。
-
(5) 装置F中的
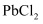 溶液吸收CO变黑色,可以处理产生的尾气,试用反应方程式分析CO产生的原因。
溶液吸收CO变黑色,可以处理产生的尾气,试用反应方程式分析CO产生的原因。