海带成分中碘的检验 知识点题库
从海带中提取碘单质,成熟的工艺流程如下:干海带 海带灰
海带灰 悬浊液
悬浊液 滤液
滤液 碘水
碘水 的CCl4溶液
的CCl4溶液 下列关于海水制碘的说法,不正确的是( )
下列关于海水制碘的说法,不正确的是( )
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如下:
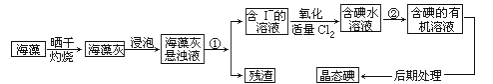
-
(1) 指出取提碘的过程中有关的实验操作名称:① ;② ;写出过程②中有关反应的化学方程式
-
(2) 提取碘过程中,可供选择的有机试剂是 .
A.甲苯、酒精
B.四氯化碳、苯
C.汽油、乙酸
D.汽油、甘油
-
(3) 为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品.尚缺少的玻璃仪器是
 海带灰
海带灰  悬浊液
悬浊液 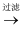 滤液
滤液  碘水
碘水  I2的CCl4溶液
I2的CCl4溶液  I2下列关于海水制碘的说法,不正确的是( )
I2下列关于海水制碘的说法,不正确的是( )
 6Cu+7CO2↑+2H2O
6Cu+7CO2↑+2H2O
![]()
-
(1) 在工业生产中金属冶炼的原理错误的是
A 电解熔融的 NaCl 来制取 Na
B 电解熔融的 AlCl3 来制取 Al
C CO 还原 Fe2O3 制取 Fe
D 铝热反应原理制锰:4Al+3MnO2
 3Mn+2 Al2O3
3Mn+2 Al2O3 -
(2) 下图是从海水中提取溴的简单流程:

提取溴的过程中,经过 2 次 Br-
 Br2 转化的目的是
Br2 转化的目的是 -
(3) 吸收塔中发生反应的离子方程式是
-
(4) 海带中富含碘元素,实验室从海带中提取 I2 的途径如下图所示:

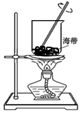
①步骤 I 灼烧海带至灰烬时所用的主要仪器名称是 。
②步骤 IV 向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式 。
③步骤 V 加入萃取剂 M 为 ,步骤 VI 从 I2 的有机溶液获得 I2 可以用 的方法。
-
(1) 步骤Ⅱ通入热空气吹出 Br2 , 利用了溴的_______(填序号)。A . 氧化性 B . 还原性 C . 挥发性 D . 腐蚀性
-
(2) 步骤Ⅱ中涉及的离子反应如下,请在横线上填入正确的化学计量数:
Br2 +
 =
=  + Br- +CO2↑
+ Br- +CO2↑ -
(3) 上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后 进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为。
-
(4) 实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有________________(填字母)。A . 乙醇 B . 四氯化碳 C . 醋酸 D . 苯
-
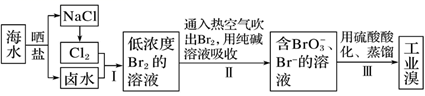
(1) Ⅰ.工业海水淡化及从海水中提取溴的过程如下:
请回答下列问题:
历史最久,技术和工艺也比较成然,但成本较高的海水淡化的方法是法。
-
(2) 从海水中可以得到食盐,为了除去粗盐中的Ca2+、Mg2+、
 ,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是______(填字母)。
A . ⑤④②③① B . ④①②⑤③ C . ②⑤④①③ D . ②④⑤①③
,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是______(填字母)。
A . ⑤④②③① B . ④①②⑤③ C . ②⑤④①③ D . ②④⑤①③ -
(3) 步骤Ⅰ中已获得Br2 , 步骤Ⅱ中又将Br2还原为Br- , 其目的为。
-
(4) 步骤Ⅱ用SO2水溶液吸收Br2 , 反应的离子方程式为。
-
(5) 从理论上考虑,下列物质的溶液也能与Br2反应的是______(填字母)。A . NaCl B . Na2CO3 C . Na2SO3 D . FeCl3
-
(6) Ⅱ.金属矿物冶炼得到的铁屑和海带中提取的碘可以用于生产KI,工艺流程如图所示:
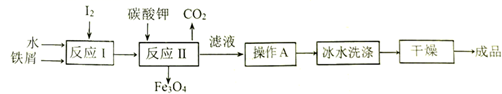
请回答下列问题:
KI的溶解度随温度变化比较大,操作A包括、、过滤。
-
(7) 用冰水洗涤的目的是除去附着在KI表面的可溶性杂质,同时。
-
(8) 反应Ⅰ生成了铁与碘的化合物X,若X中铁元素与碘元素的质量比为21∶127,则X的化学式为。
-
(9) 写出反应Ⅱ的化学方程式。
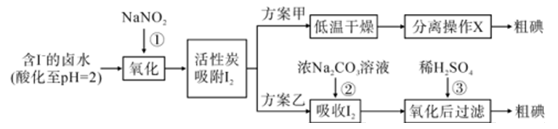
资料显示:
I.pH=2时,NaNO2溶液只能将I- 氧化为I2 , 同时生成 NO
II. I2+5Cl2+6H2O = 2HIO3+10HCl,5  +2
+2  +2H+ = I2+5
+2H+ = I2+5  +H2O
+H2O
-
(1) 反应①的离子方程式。
-
(2) 方案甲中,根据I2的特性,分离操作 X 的方法是。
-
(3) 已知:反应②中每吸收3molI2转移5mol电子,离子方程式是。
-
(4) Cl2、酸性 KMnO4 等都是常用的强氧化剂,但该工艺中氧化卤水中的I- 却选择了价格较高的NaNO2 , 原因是。
-
(1) 铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应,如:2Al+Fe2O3
 2Fe+Al2O3 , 反应发生时放出大量的热。
2Fe+Al2O3 , 反应发生时放出大量的热。 ①“铝热反应”属于四种基本反应类型中的反应。
②信息中的“某些”指(填“比铝活泼”“比铝不活泼”或“任意”)。
③试写出铝粉与MnO2发生的铝热反应方程式:。
-
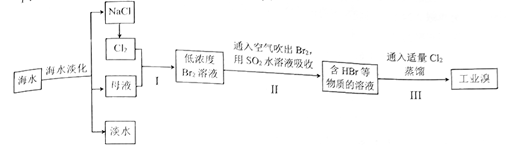
(2) 从海水中提取溴的工业流程如图:
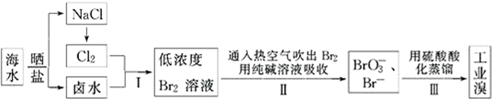
①步骤I中发生反应的离子方程式为。
②步骤II用热空气吹出的Br2被纯碱溶液吸收时,则被氧化和被还原的Br2的物质的量之比为。
-
(3) 海带中含有丰富的碘元素,某化学研究性学习小组用如图流程从海水中提取碘:

①若操作I用H2O2溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程为。
②操作II的名称为、,此过程中可以选用的有机溶剂是(填一种)。
| | | | |
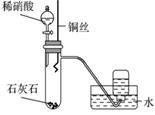
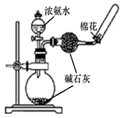
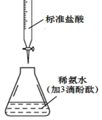
| A.验证稀硝酸的还原产物为NO | B.灼烧海带 | C.制取并收集NH3 | D.用滴定法测氨水的物质的量浓度 |
 B . 铝热反应
B . 铝热反应 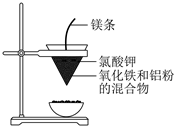 C . 石油的分馏
C . 石油的分馏 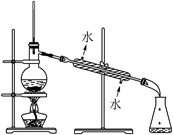 D . 分离乙酸乙酯和水
D . 分离乙酸乙酯和水 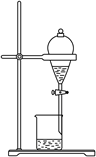
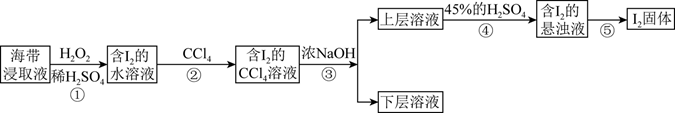
-
(1) 步骤①中发生反应的离子方程式为,当生成0.3molI2时,转移电子的物质的量为mol。
-
(2) 向含有I2的水溶液中加入CCl4振荡静置后的实验现象为。
-
(3) 步骤③中发生反应的化学方程式为。
-
(4) 步骤⑤的实验操作名称为。
-
(5) 步骤③④是利用化学转化法将富集在四氯化碳中的碘单质重新富集在水中,该方法称为法。

-
(1) 操作①的名称是,在该操作中除了用到玻璃棒、烧杯外,还缺少的玻璃仪器有;操作③的名称是,在该操作中用到的主要玻璃仪器是。
-
(2) ③过程中,可供选择的有关试剂是。
A.酒精 B.四氯化碳 C.醋酸
将你所选择的试剂滴加到含I2的水溶液中,振荡后静置,可观察到的现象是。
-
(3) 请设计一种检验提取碘后的水层中是否还含有单质碘的简单方法。