铁及其化合物的性质实验 知识点题库
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6
mol·L-1盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。填写下列空白:
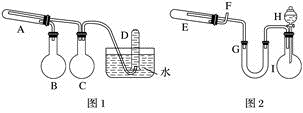
-
(1) 实验进行时试管A中应加入的试剂是;烧瓶B的作用是;烧瓶C的作用是;在试管D中收集得到的是。
-
(2) 实验时,U形管G中应加入的试剂是;长颈漏斗H中应加入。
-
(3) 两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)。
-
(4) 试管E中发生反应的化学方程式是。
-
(5) 为了安全,在E管中的反应发生前,在F出口处必须;E管中的反应开始后,在F出口处应。
下列有关铁及其化合物的说法中正确的是( )
A . 铁与水蒸气在高温下的反应产物为Fe2O3和H2
B . 氢氧化亚铁是红褐色沉淀
C . Fe3+与KSCN溶液产生红色沉淀
D . 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
某实验小组拟用碱性烂版液{主要成分为[Cu(NH3)4]Cl2和Cu(OH)2}为原料制取摩尔盐,并回收铜单质,设计流程如图:
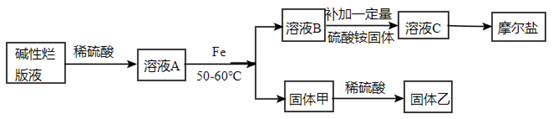 已知:温度超过60℃时, FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
已知:温度超过60℃时, FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
-
(1) 写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式。
-
(2) 实验中第一步所用硫酸浓度为4mol/L,不能太小,原因是。
-
(3) 关于该实验过程的下列说法中正确的是_______。A . 所加铁粉应该先用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示:
 B . 溶液A与铁粉反应,若温度高于60℃,会导致回收的铜不纯净
C . 硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解1mol铁粉,则所加硫酸铵也约为1 mol
D . 溶液B的pH控制在5~6之间,若pH过高, 可用硫酸调节,以抑制Fe2+水解
B . 溶液A与铁粉反应,若温度高于60℃,会导致回收的铜不纯净
C . 硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解1mol铁粉,则所加硫酸铵也约为1 mol
D . 溶液B的pH控制在5~6之间,若pH过高, 可用硫酸调节,以抑制Fe2+水解
-
(4) 为从溶液C中得到较纯的摩尔盐,请选择下列合适的操作并排序:。
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤 ⑤冷却结晶 ⑥干燥
-
(5) 如何检验摩尔盐已经洗涤干净:。
-
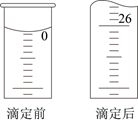
(6) 为了测定产品中摩尔盐(M=392g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.080 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为。
草酸(  )及其化合物广泛分布于动植物体中。
)及其化合物广泛分布于动植物体中。
 )及其化合物广泛分布于动植物体中。
)及其化合物广泛分布于动植物体中。 Ⅰ.某实验小组分别用水煮检验法和灼烧检验法对菠菜中的铁元素(主要以难溶的 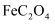 形式存在)进行检测。实验如下:
形式存在)进行检测。实验如下:
a.水煮检验法:

b.灼烧检验法:

-
(1) 灼烧菠菜时应将其放在(填仪器名称)中加热。
-
(2) 溶液A中未能检测出
 的可能原因是;
的可能原因是;
-
(3) 取溶液B,先滴加
 溶液、再滴加
溶液、再滴加 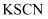 溶液。溶液呈红色;用离子方程式表示
溶液。溶液呈红色;用离子方程式表示  的作用:。
的作用:。
-
(4) 甲同学取少量溶液B,滴加酸性
 溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有
溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有  。乙同学认为甲同学的实验方法不严谨,理由是。
。乙同学认为甲同学的实验方法不严谨,理由是。
-
(5) Ⅱ.利用草酸制备草酸亚铁晶体(
 )的流程及组分测定方法如下:
)的流程及组分测定方法如下: 
已知:几种物质的溶解度(
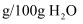 )如下:
)如下:


20℃
48
75
37
60℃
101
88
38
趁热过滤的原因是:。
-
(6) 氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M),称取ag草酸亚铁晶体置于锥形瓶中,用稀硫酸将其溶解,再用
 的高锰酸钾标准液滴定,滴定时,眼睛应注视。到达滴定终点时,消耗高锰酸钾
的高锰酸钾标准液滴定,滴定时,眼睛应注视。到达滴定终点时,消耗高锰酸钾 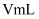 ,则
,则 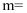 。(已知:
。(已知:  )
)
最近更新



