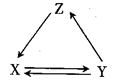
铁及其化合物的性质实验 知识点题库
Ⅰ.配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉.
Ⅱ.实验探究Fe3+与Fe2+相互转化
实验1:0.1mol/L FeCl2溶液  无明显现象
无明显现象  溶液变红
溶液变红
实验2:0.1mol/L FeCl3溶液  溶液变红
溶液变红 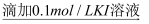 溶液红色未褪去
溶液红色未褪去
-
(1) 写出Fe(OH)2Cl与盐酸反应的离子方程式.
-
(2) 请用离子方程式解释实验1中滴加氯水后溶液变红的原因.
-
(3) 实验2的现象与预测不同,为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10mL 0.1mol/L KI溶液
 溶液明显变黄
溶液明显变黄步骤2:将黄色溶液分为三份:
试管1 取2mL黄色溶液
 溶液变红
溶液变红试管2 取3mL黄色溶液
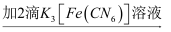 溶液变蓝
溶液变蓝试管3 取3mL黄色溶液
 取上层溶液
取上层溶液 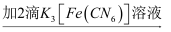 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)①试管2中滴加K3[Fe(CN)6]检验的离子是.
②黄色溶液中含有的溶质微粒有K+、Cl﹣ 和.
③综合上述实验现象,得出的实验结论是.
-
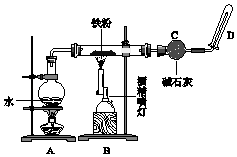
(1) 装置A的作用是.
-
(2) B中反应的化学方程式:.
-
(3) 碱石灰的作用是.
-
(4) 在D处玻璃管口点燃生成的气体前,必须对该气体进行,这一操作的目的是.
-
(5) 当有16.8g 铁粉参加反应时,生成的气体在标准状况下的体积是 L.

-
(1) 写出下列物质的化学式:DX
①反应3的离子方程式为。
②反应6的离子方程式为:。
③反应7的化学方程式为:。
④反应5的化学方程式为。
-
(2) 在反应①~⑦中,不属于氧化还原反应的是(填编号)。
-
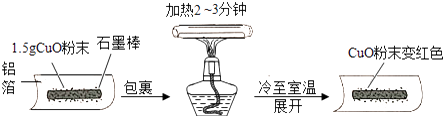
(1) 【猜想】把氧化铜还原成铜的物质是:Ⅰ石墨;Ⅱ.
-
(2) 【实验】用天平称量1.5g氧化铜粉末,直接用铝箔纸包裹.按上述操作步骤实验,黑色粉末,那么猜想Ⅱ不成立.
-
(3) 【实验】石墨棒能使氧化铜还原成铜,该反应的化学方程式为
-
(4) 【改进】把石墨棒换成铝粉重复上述操作,又获成功.那么称取等量的铝粉并进行同样的操作,其目的是.改进后的实验证明,金属铝与铜活动顺序是,该反应的化学方程式为
-
(5) 【拓展】如果使用复印机的“碳粉”代替石墨棒还原氧化铜,效果更好.联想在空气中灼烧的铁丝不能燃烧,而铁粉能燃烧,其原因是.
| X | Y | Z | 物质转化关系 | |
| A | Cu | CuO | Cu(OH)2 | |
| B | Si | SiO2 | H2SiO3 | |
| C | NaHCO3 | Na2CO3 | NaOH | |
| D | FeCl2 | FeO | FeCl3 |
-
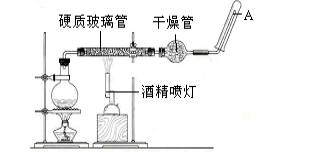
(1) 写出该反应的反应方程式:;并指明该氧化还原反应的还原剂是 ,氧化剂是。
-
(2) 圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,其作用是 。
-
(3) 酒精灯和酒精喷灯点燃的顺序是 ,为什么。
-
(4) 试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 。

-
(1) “浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2 , O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为。
②加入硫酸的目的是;加入活性炭能降低有害气体的产生,这是因为。
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是
 图-1
图-1 图-2
图-2 -
(2) “制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是;写出生成FePO4·2H2O的离子方程式:。
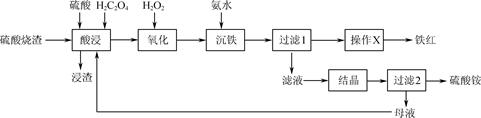
已知:H2C2O4可沉淀Ca2+、Fe2+等金属离子,可与Fe3+生成[Fe(C2O4)3]3- , 在硫酸作用下可热分解生成CO和CO2。
-
(1) 用50%的硫酸“酸浸”时,反应液的温度、H2C2O4的加入量对铁浸取率的影响分别如图1、图2所示:

①“硫酸烧渣”中Fe2O3与H2SO4反应的化学方程式为。
②图1中,反应液的温度高于95℃时,铁浸取率开始降低,其原因是。
③图2中,H2C2O4加入量在5~20%时,铁浸取率随加入量的增大而增大,其原因是;H2C2O4加入量超过20%时,铁浸取率反而开始降低,其原因是。
-
(2) “沉铁”时发生的主要反应的离子方程式为。
-
(3) 由“过滤1”的滤渣制备铁红的“操作X”为。
①金属钠投入FeCl3溶液中
②少量Ca(OH)2投入过量NaHCO3溶液中
③向饱和Na2CO3溶液中通入足量CO2
④向AlCl3溶液中滴入NaHCO3溶液
⑤过量NaOH溶液和明矾溶液混合
-
(1) Ⅰ.为探究SO2气体的还原性,某实验小组的同学利用如下图所示装置进行实验。
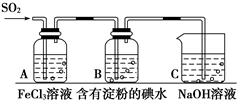
装置A中发生反应的离子方程式为。
-
(2) 装置C的作用是。
-
(3) 在上述装置中通入过量的SO2 , 为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液少量,分成两份,并设计了如下实验方案:
方案①:向第一份溶液中加入少量酸性KMnO4溶液,发现紫红色褪去;
方案②:向第二份溶液中加入少量KSCN溶液,发现不变红,再加入少量新制的氯水,溶液变红。上述方案中不合理的是,原因是。
-
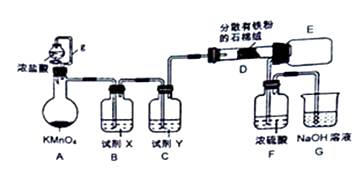
(4) Ⅱ.无水FeCl3在空气中易潮解,遇水水解,加热易升华。实验室可用下列装置制备。
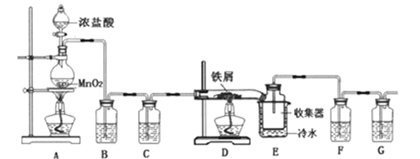
反应开始后,装置D硬质玻璃管中出现的现象为。
-
(5) 装置F中所盛的试剂为。
-
(6) 下列有关该实验的说法中,错误的是___________A . B装置的作用是除去HCl,并能减少Cl2的溶解 B . E装置中冷水的作用是冷却,使FeCl3冷却沉积 C . 若氯气不足则会产生FeCl2 D . 向烧瓶中加入足量的AgNO3和稀硝酸,可确定生成的MnCl2的质量
已知:K2FeO4为紫色固体,微溶于KOH溶液中呈紫色溶液;具有强氧化性,在酸性或中性溶液中快速产生O2 , 在碱性溶液中较稳定。
-
(1) Ⅰ.制备K2FeO4(夹持装置略)

装置A为氯气发生装置,装置C中得到紫色固体和溶液。请写出C中由Cl2参加反应生成高铁酸钾的化学方程式。
-
(2) 将装置C中所得混合物进行抽滤,请选择合适的操作并排序。
a.倾析法转移溶液
b.转移固体至漏斗
c.使用玻璃砂漏斗
d.开大抽气装置水龙头
e.关闭抽气装置水龙头
f.断开抽气泵和吸滤瓶之间的橡皮管
g.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
h.用蒸馏水润湿滤纸,微开水龙头,使滤纸与漏斗瓷板紧贴
-
(3) Ⅱ.探究K2FeO4的性质
取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2 , 设计以下方案:
①用KOH溶液充分洗涤装置C中所得固体
②再用KOH溶液将固体K2FeO4溶出,得到紫色溶液a取少量a,滴加盐酸,有Cl2产生。该方案可证明K2FeO4氧化了Cl- , ①中用KOH溶液洗涤的目的是。
-
(4) 资料表明,酸性溶液中的氧化性FeO
 >MnO
>MnO 。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO
。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO >MnO
>MnO 。请说明理由。
。请说明理由。
-
(5) Ⅲ.K2FeO4产品纯度的测定
准确称取3.00gK2FeO4样品于锥形瓶中,加入足量KOH溶液和50.00mL0.4200mol•L-1Na3AsO3溶液,充分反应后加入稀硫酸酸化,用0.1000mol•L-1KBrO3标准溶液滴定剩余的Na3AsO3溶液,恰好完全反应时消耗KBrO3标准溶液的体积为20.00mL。(K2FeO4摩尔质量为198gmol•L-1)
已知测定过程中发生的反应有:
FeO
 +AsO
+AsO +H2O→Fe(OH)3+AsO
+H2O→Fe(OH)3+AsO +OH-(未配平)
+OH-(未配平)AsO
 +BrO
+BrO →AsO
→AsO +Br-(未配平)
+Br-(未配平)样品中K2FeO4的质量分数为(保留三位有效数字,杂质不参与化学反应)。
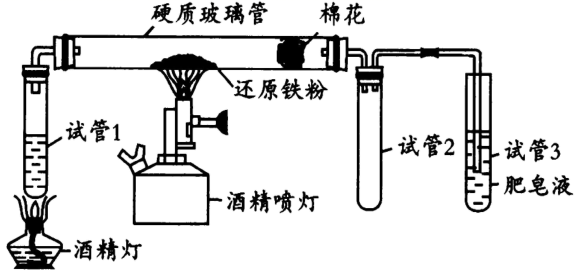
回答下列问题:
-
(1) 写出铁和水蒸气反应的化学方程式,并用双线桥表明电子转移的方向和数目;试管2的作用是。
-
(2) 酒精灯与酒精喷灯点燃顺序为,理由是。
-
(3) 通过点燃试管3中产生的肥皂泡,来检验生成的气体,肥皂液的作用是。
-
(4) 检验反应后的固体是否存在Fe3O4 , 引起小组成员争论:
①甲同学认为可以使用化学方法,先用足量盐酸溶解,再分别检验Fe2+和Fe3+。大家认为该方法不合理,请写出至少1条理由;
②乙同学认为可以利用Fe3O4的磁性检验。由于铁粉和生成的Fe3O4难以分离鉴别,乙同学查阅资料之后,用极细钢丝网代替铁粉进行实验。在实验前后分别剪下少量钢丝,用铁片靠近钢丝,观察到现象,证明了反应后的固体中含有Fe3O4。
选项 | 实验操作 | 类比 |
A | 电解CuSO4溶液可以得到Cu单质 | 电解Al2(SO4)3溶液可以制备Al单质 |
B | Fe在常温下遇到浓硫酸钝化 | Mg在常温下遇到浓硫酸也会纯化 |
C | CCl4可以萃取碘水中的I2 | CCl4可以萃取溴水中的Br2 |
D | 往NaHCO3溶液中滴入酚酞溶液,溶液变红 | NaHSO4溶液也能使酚酞溶液变红 |

下列说法错误的是( )
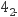 +3Cl-+10H+
D . iv 中反应说明溶解度:Na2FeO4>K2FeO4
+3Cl-+10H+
D . iv 中反应说明溶解度:Na2FeO4>K2FeO4

下列叙述不正确的是( )