指示剂 知识点题库
以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l) SO32-+SO2+ . 若以液态SO2为溶剂,用SOCl2滴定Cs2SO3 , 则以下叙述错误的是 ( )
SO32-+SO2+ . 若以液态SO2为溶剂,用SOCl2滴定Cs2SO3 , 则以下叙述错误的是 ( )
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.100 0 mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是( )
绪言课上,老师在滤纸上用酚酞溶液画漫画,然后再喷洒某种液体X,滤纸上立即显示出红色图象.则X可能是( )

取某无色饮料20.00 mL加入稀硫酸充分煮沸,冷却,加入过量氢氧化钠溶液并稀释至 100.00 mL。取 10.00 mL 稀释液,加入 30.00 mL 0.01500 mol ·L-1I2 标准溶液,置于暗处15分钟,滴加2〜3滴淀粉溶液,再用0.01200 mol • L-1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液25.00 mL。
已知:①I2在碱性条件下能与葡萄糖发生如下反应:
C6H12O6+I2+3NaOH = C6H11O7Na+2NaI+2H2O
② Na2S2O3 与I2 能发生如下反应:I2+2Na2S2O3 = 2NaI+Na2S4O6
-
(1) 配制100.00mL0.01500mol·L-1I2标准溶液,所必需的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
-
(2) 向饮料中加入稀硫酸并充分煮沸的目的是。
-
(3) 滴定终点的现象为。
-
(4) 计算该饮料中糖类物质的含量(单位:mg·mL-1)。
 。25℃时,用0.100 mol•L-1的NaOH溶液滴定20.00 mL 0.100 mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
。25℃时,用0.100 mol•L-1的NaOH溶液滴定20.00 mL 0.100 mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )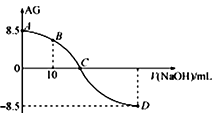
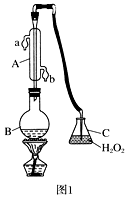

-
(1) 仪器A的名称是,水通入A的进口为。
-
(2) B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为。
-
(3) 除去C中过量的H2O2 , 然后用0.090 00 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的;
若滴定终点时溶液的pH=8.8,则选择的指示剂为;
若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)(①=10 mL,②=40 mL,③<10 mL,④>40 mL )。
下列说法正确的是( )
甲基橙:3.1~4.4 石蕊:`5.0~8.0 酚酞:8.2~10.0
用0.1000 mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时。下列叙述正确的是( )
 )是重要的化工原料,呈白色粉末,不溶于水。制取钛白的方法主要有两种。
)是重要的化工原料,呈白色粉末,不溶于水。制取钛白的方法主要有两种。
-
(1) 方法一:气相氧化法。反应原理为
 。实验室模拟制备二氧化钛的气相氧化装置如图(部分夹持装置已略去)。
。实验室模拟制备二氧化钛的气相氧化装置如图(部分夹持装置已略去)。已知:
 熔点为-24.1℃,沸点为136.4℃,在空气中发烟,生成二氧化钛固体和白雾。
熔点为-24.1℃,沸点为136.4℃,在空气中发烟,生成二氧化钛固体和白雾。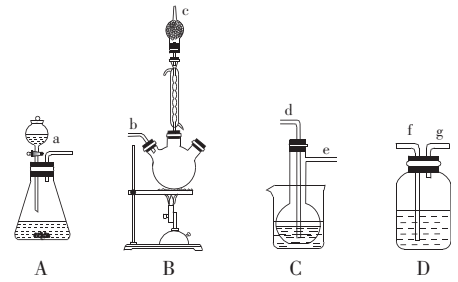
回答下列问题:
实验装置的连接顺序为a→→→→→→。
-
(2) A装置中发生反应的化学方程式为。
-
(3) B装置干燥管的作用为。
-
(4) C装置的加热方式为(填“水浴加热”或“油浴加热”)。
-
(5) D装置中试剂为。
-
(6) 方法二:硫酸法。70~80℃条件下,不断通入空气并搅拌,钛铁矿同浓硫酸反应制得可溶性,硫酸盐。
 称为钛酰离子,易水解生成钛酸,进而制得钛白。在制取钛白的过程中,需要测定钛液中的含量。首先用铝片将还原为
称为钛酰离子,易水解生成钛酸,进而制得钛白。在制取钛白的过程中,需要测定钛液中的含量。首先用铝片将还原为 , 再用
, 再用 标准溶液滴定(反应原理为
标准溶液滴定(反应原理为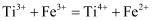 )。
)。滴定次数
待测溶液的体积/mL
标准溶液的体积/mL
滴定前刻度
滴定后刻度
1
25.00
0.11
8.61
2
25.00
7.51
15.00
3
25.00
0.30
7.81
滴定时可选用指示剂为,滴定终点溶液的颜色变化为,钛液中
 的浓度为
的浓度为 (以
(以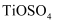 计)。
计)。
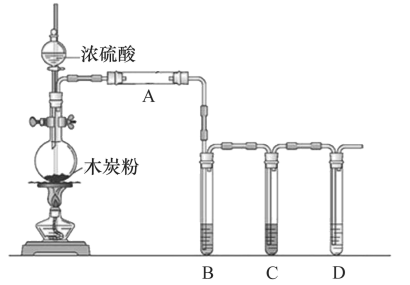
-
(1) 圆底烧瓶中发生反应的化学方程式为。
-
(2) A中应加入的试剂是。
-
(3) B中实验现象是,证明产物中有。
-
(4) C中装有过量的酸性高锰酸钾溶液,其作用是。
-
(5) 证明产物中有CO2的实验现象。
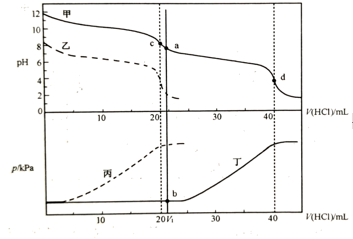
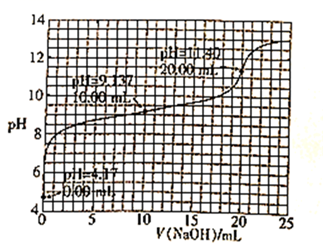
下列说法正确的的是( )
 +H+=CO2↑+H2O
C . 根据pH—V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点
D . Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO
+H+=CO2↑+H2O
C . 根据pH—V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点
D . Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO )=c(OH-)-c(H+)
)=c(OH-)-c(H+)
 ]常用于干粉灭火剂。某研究小组用磷酸吸收氢气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氢气制备 , 装置如图所示(夹持和搅拌装置已省略)。
, 装置如图所示(夹持和搅拌装置已省略)。
回答问题:
-
(1) 实验室用
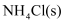 和
和 制备氨气的化学方程式为。
制备氨气的化学方程式为。
-
(2) 现有浓
 质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的
质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的 溶液,则需浓
溶液,则需浓 mL(保留一位小数)。
mL(保留一位小数)。
-
(3) 装置中活塞
 的作用为。实验过程中,当出现现象时,应及时关闭
的作用为。实验过程中,当出现现象时,应及时关闭 , 打开
, 打开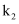 。
。
-
(4) 当溶液pH为8.0~9.0时,停止通
 , 即可制得
, 即可制得 溶液。若继续通入
溶液。若继续通入 , 当
, 当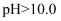 时,溶液中
时,溶液中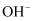 、和(填离子符号)浓度明显增加。
、和(填离子符号)浓度明显增加。
-
(5) 若本实验不选用pH传感器,还可选用作指示剂,当溶液颜色由变为时,停止通
 。
。



