指示剂 知识点题库
从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:HIn(aq,红色)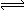 H+(aq)+In-(aq,黄色)而用作酸碱指示剂.往该溶液中加入Na2O2粉末,则溶液颜色为( )
H+(aq)+In-(aq,黄色)而用作酸碱指示剂.往该溶液中加入Na2O2粉末,则溶液颜色为( )
编号 | 实验事实 | 实验结论 |
A | 某溶液能使酚酞溶液变红 | 该溶液一定是NaOH溶液 |
B | 某物质可以导电 | 该物质一定是金属单质 |
C | 常温下,测定某溶液的pH=3 | 该溶液一定呈酸性 |
D | 某气体不能使带火星的木条复燃 | 该气体一定不含氧气 |
-
(1) 该学生的操作 (填“正确”或“错误”),其理由是
-
(2) 如不正确请说明理由,同时请分析是否一定有误差?
-
(3) 若用此方法分别测定c(OH﹣)相等的氢氧化钠溶液和氨水的pH,误差较大的是 ,原因是
-
(4) 只从下列试剂中选择实验所需的试剂,你能否区分0.1mol•L﹣1硫酸溶液和0.01mol•L﹣1硫酸溶液? ,简述操作过程.
试剂:A.紫色石蕊试液 B.酚酞试液 C.甲基橙溶液 D.蒸馏水 E.氯化钡溶液 F.pH试纸.
①滴有石蕊的H2SO4溶液 ②滴有酚酞的氨水溶液
③滴有酚酞的氢氧化钠溶液 ④滴有酚酞的饱和氢氧化钙溶液
⑤滴有酚酞的Na2CO3溶液 ⑥溶有SO2的品红溶液.
-
(1) 有两瓶pH=12的碱溶液,一瓶是强碱,一瓶是弱碱.现有石蕊试液、酚酞试液、pH试纸和蒸馏水,而无其它试剂,简述如何用最简单的方法判断哪瓶是强碱.
-
(2) 有两份等体积的0.1mol/L的醋酸溶液,分别用蒸馏水和0.1mol/L的醋酸钠溶液稀释100倍,用0.1mol/L的醋酸钠溶液稀释后的溶液pH较(填:“大”或“小”)原因:.
I.用热浓硫酸处理0.25g谷物样品,把有机氮转化为铵盐。
II.用下图所示装置处理上述铵盐(夹持装置略去)。

回答下列问题:
-
(1) 实验前要检验B装置的气密性,具体操作为。
-
(2) 盛放氢氧化钠溶液的仪器名称为;玻璃管2的作用是;圆底烧瓶中碎瓷片的作用是。
-
(3) 将“谷物处理后所得的铵盐”加入三颈瓶中,打开玻璃塞、旋开K2 , 加入足量氢氧化钠溶液,关闭K2 , 打开K1 , 点燃酒精灯使水蒸气进入B装置。
①B装置中反应的离子方程式为。
②C装置冰水混合物的作用是。
-
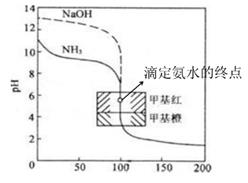
(4) III.滴定、计算氮的含量
取下锥形瓶,加入指示剂,用0.10mol/L的NaOH溶液滴定,重复滴定3次,平均消耗19.30mLNaOH溶液。
①该滴定的指示剂应选择。
a.甲基橙
b.配酞
c.甲基橙或酚酞
②该谷物样品中氮的百分含量为。(保留2位小数)
① 准确称取4.080g邻苯二甲酸氢钾加入250mL锥形瓶中;
② 向锥形瓶中加30mL蒸馏水溶解;
③ 向溶液中加入1~2滴指示剂;
④ 用氢氧化钠溶液滴定至终点;
⑤ 重复以上操作;
⑥ 根据数次实验数据计算氢氧化钠的物质的量的浓度。
已知:Ⅰ、到达滴定终点时,溶液的pH约为9.1。
Ⅱ、邻苯二甲酸氢钾在水溶液中可以电离出一个H+
Ⅲ、邻苯二甲酸氢钾的相对分子质量为204
指示剂 | 酚酞 | 甲基橙 | |||||
pH范围 | <8.2 | 8.2 ~ 10 | >10 | <3.1 | 3.1 ~ 4.4 | >4.4 | |
颜色 | 无色 | 粉红色 | 红色 | 红色 | 橙色 | 黄色 | |
-
(1) 为标定氢氧化钠溶液的浓度,应选用作指示剂;
-
(2) 完成本实验,已有电子天平、铁架台、滴定管夹、锥形瓶、烧杯等,还必须的仪器是:;
-
(3) 判断到达滴定终点的实验现象是;
-
(4) 在整个滴定过程中,两眼应该注视着;
-
(5) 滴定实验记录数据如下表,则NaOH溶液的浓度为;
实验编号
m(邻苯二甲酸氢钾)/g
V(NaOH)/mL
初始读数
末尾读数
1
4.080
0.50
20.52
2
4.080
1.00
20.98
3
4.080
0.20
24.80
-
(6) 滴定过程中,下列操作能使测定结果(待测液的浓度数值)偏小的是____________。A . 上述操作中,将邻苯二甲酸氢钾直接放入锥形瓶中溶解 B . 滴定管在滴定开始时尖嘴有气泡,滴定完成时气泡消失 C . 滴定完毕,尖嘴外留有液滴或溶液滴在锥形瓶外 D . 滴定前仰视读数而滴定终了俯视读数

(以下均假设反应过程中溶液体积不变)。
-
(1) 铁片上的电极反应式为,
-
(2) 铜片周围溶液会出现的现象。
-
(3) 若2 min后测得铁片和铜片之间的质量差为1.2 g,计算:导线中流过的电子的物质的量为mol;
-
(4) 金属的电化学腐蚀的本质是形成了原电池。如下图所示,烧杯中都盛有稀硫酸。

①图2 B中的Sn为极,Sn极附近溶液的pH(填“增大”“减小”或“不变”)。
②图2 C中被腐蚀的金属是。比较A,B,C中纯铁被腐蚀的速率由快到慢的顺序是。
-
(5) 人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的电极反应是:。电池工作一段时间后硫酸溶液的浓度(填“增大”“减小”或“不变”)。
-
(1) 甲组同学用下列装置制取H2和Cl2。
①实验室常用NaCl+H2SO4(浓)→NaHSO4+HCl↑反应制备HCl气体,该反应利用了浓硫酸的性。
②用工业级锌粒(主要成分 Zn,含少量 FeS、Pb、Cu 等杂质)作原料,装置 I、Ⅱ均可以制取 H2 , 但装置 I 比装置Ⅱ更好,理由;检验氯气所用的试纸是。
-
(2) 乙组同学拟用甲组的装置 I、Ⅲ及下列装置(可以重复选用)模拟工业上制取盐酸。

①乙组中氢气的部分实验装置连接是a-f-g-d……,其中装置Ⅴ的作用是,制取氯气并模拟合成盐酸的实验装置的合理连接顺序(用玻璃接口表示)为 c-。
②装置VII中仪器 X 的名称是 ,合成 HCl时需控制H2的体积略大于Cl2的体积,其目的是 ;装置VII末端接抽气水泵的目的是。
-
(3) 设计实验证明HCl极易溶于水且水溶液呈酸性:。
 的含量。先将部分变质的烧碱配制成一定浓度溶液并加入一种指示剂,用一定浓度的HCl溶液滴定至变色后,再加入另一种指示剂,继续用该HCl溶液滴定至变色,分别记录两个变色点加入HCl溶液体积进行计算。滴定过程中溶液pH的变化如图所示。下列说法错误的是( )
的含量。先将部分变质的烧碱配制成一定浓度溶液并加入一种指示剂,用一定浓度的HCl溶液滴定至变色后,再加入另一种指示剂,继续用该HCl溶液滴定至变色,分别记录两个变色点加入HCl溶液体积进行计算。滴定过程中溶液pH的变化如图所示。下列说法错误的是( ) 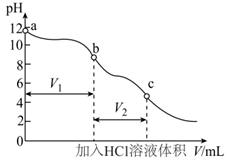
 C . 若
C . 若  ,则a点溶液中存在
,则a点溶液中存在 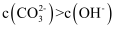 D . 原固体混合物中碳酸钠的质量分数表示为
D . 原固体混合物中碳酸钠的质量分数表示为 
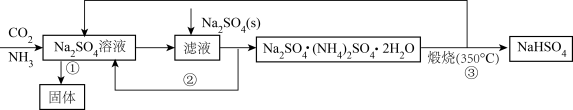
某化学兴趣小组在实验室中根据上述流程进行模拟实验。流程中①中的反应实验装置图(待完善)如下。 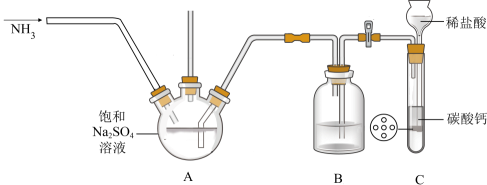
请回答:
-
(1) 流程中反应①后所获固体主要成分是(用化学式表示)。写出反应③生成NaHSO4的化学反应方程式。
-
(2) 装置图中B的作用是。
-
(3) 实验时持续通NH3 , 但A中产生少量固体后便不再继续反应,此时B、C中可能观察到的现象是。
-
(4) 下列说法中错误的是____。A . 反应②能生成复盐Na2SO4·(NH4)2SO4·2H2O的主要原因是其溶解度较小 B . 抽滤过程中应注意观察吸滤瓶内液面高度,当快达到吸滤瓶支管口时,应拔掉吸滤瓶上的橡皮管,从吸滤瓶支管口倒出溶液 C . 依据该流程闭路循环绿色的特点,“煅烧(350℃)”的实验中最好用稀硫酸处理尾气 D . 装置图A中的长玻璃导管下端应浸入溶液中,作用是作为安全管 E . 利用该流程制备两种盐的总反应方程式为Na2SO4+CO2+H2O=NaHSO4+NaHCO3
-
(5) 测定NaHSO4的纯度:称取一定质量所得产品配成250mL溶液,用移液管取出15.00mL,用NaOH标准溶液滴定。
①实验过程中,移液管洗涤干净并用蒸馏水清洗2~3次后,进行的后续一系列操作如下。
a.吸取少量待取液润洗2~3次
b.将润洗好的移液管插入待取溶液底部,吸取溶液使液面至标线以上
c.松动食指使液面缓慢下降至溶液的凹液面与标线相切,立即按紧管口
d.用吸水纸吸净尖端内、外的残留水
e.将润洗好的移液管插入待取溶液液面下约1-2cm处,吸取溶液使液面至标线以上
f.将移液管提出液面,倾斜容器,将管尖紧贴容器内壁成约45°角,稍待片刻
g.拿掉洗耳球,立即用食指堵住管口,使液体不再流出
h.当溶液流尽后,再停数秒,并将移液管向左右转动一下,取出移液管
i.将移液管垂直放入稍倾斜的锥形瓶中,并使管尖与容器内壁接触,松开食指使溶液全部流出
请选择正确操作的编号,按顺序排列:→→→g→f→→→(序号不重复)
②为使实验结果更加精确,滴定过程中最好选用下列指示剂中的哪一种。
A.甲基橙 B.石蕊 C.酚酞



