指示剂 知识点题库
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.100 0 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是 ( )
颜色 | 红 | 橙 | 绿 | 蓝 | 紫 |
PH范围 | 1~3 | 4~5 | 6~7 | 8~11 | 11~14 |
①用蒸馏水洗涤碱式滴定管后,直接装入已知浓度的NaOH溶液;
②经检查碱式滴定管不漏液,胶管中玻璃珠控制灵活后,用少量已知的NaOH溶液洗涤2~3次后再装入碱液,将液面调至刻度“0”处,用滴定管夹将其固定在铁架台上;
③用待测盐酸润洗移液管移取一定体积的待测盐酸溶液,放至用蒸馏水洗净的锥形瓶中;
④往锥形瓶中滴加几滴甲基橙,在瓶下垫一张白纸;
⑤手捏碱式滴定管中的玻璃珠,快速放液以使指示剂尽快变色;
⑥指示剂变色后再滴加几滴碱液,以稳定变色。
以上操作中错误的是( )
A | B | C | D | |
纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
小烧坏中的溶液 | 浓氨水 | 浓氨水 | 氢氧化钠溶液 | 浓硫酸 |
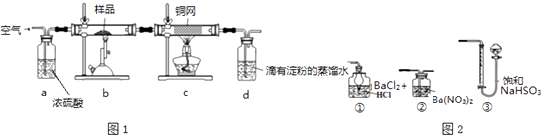
现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20mL。请回答下列问题:
-
(1) 将样品研细后再反应,其目的是。
-
(2) 装置a和c的作用分别是_和(填标号,可以多选)。
a.除去SO2气体 b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
-
(3) 滴定达终点时的现象是。
-
(4) 上述反应结束后,仍需通一段时间的空气,其目的是。
-
(5) 通过计算可知,该黄铜矿的纯度为。
乙同学在甲同学实验的基础上,设计了两种与甲不同的吸收方法,并对吸收产物进行有关处理,同样也测出了黄铜矿的纯度。
-
(6) 方法一:用如图2装置替代上述实验装置d,同样可以达到实验目的是(填序号)。
-
(7) 方法二:将原装置d中的试液改为Ba(OH)2 , 但测得的黄铜矿纯度却产生了+1%的误差,假设实验操作均正确,可能的原因主要有。

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
-
(1) 发生器中鼓入空气的作用可能是。
a.将SO2氧化成SO3 , 增强酸性
b.将NaClO3还原为ClO2
c.稀释ClO2以防止爆炸
-
(2) 吸收塔内发生反应的化学方程式为。
-
(3) 吸收塔中为防止NaClO2被还原成NaCl,需加的试剂可以选用的是(填序号)。
a.Na2O2
b.Na2S
c.FeCl2
-
(4) 从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是。
-
(5) 某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 ml待测溶液。(已知:ClO2+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00 ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml 。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为。
②该样品中NaClO2的质量分数为(用含m、c、V的代数式表示,结果化成最简)

步骤1:称取1.9640g Ka[Feb(C2O4)c]·xH2O晶体,配制成250.00mL溶液.
步骤2:取所配溶液25.00mL于锥形瓶中,加入1mol/LH2SO45.0mL,加热到70~85℃,用0.01000mol/LKMnO4溶液滴定至终点(5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O),消耗KMnO4溶液48.00mL。
步骤3:向反应后的溶液中加入一定量锌粉。加热至黄色恰好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤4:继续用0.01000mol/LKMnO4溶液滴定步骤3所得溶液至终点,消耗KMnO4溶液8.00mL。
-
(1) 步骤2中滴定终点的现象是
-
(2) 步骤3中加入锌粉的目的是
-
(3) 步聚4中发生反应的离于方程式为
-
(4) 通过计算确定该三价铁配合物的化学式(写出计算过程)。
步骤1:称量4.66g草酸铁晶体进行处理后,配制成250 mL一定物质的量浓度的溶液。
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根
恰好全部氧化成二氧化碳,同时MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至溶液黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤3:用0.0200 mol·L-1KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+。
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol·L-1 KMnO4溶液为V2、V3 mL。
记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol·L-1) | KMnO4溶液滴入的体积(mL) |
1 | 0.0200 | V1 = 20.02 |
2 | 0.0200 | V2 = 20.12 |
3 | 0.0200 | V3 = 19.98 |
请回答下列问题:
-
(1) 草酸铁溶液能做净水剂的原因(用离子方程式表示)
-
(2) 该实验步骤1和步骤3中使用的仪器除托盘天平、铁架台、滴定管夹、烧杯、玻璃棒外,一定需用下列仪器中的 (填序号)
A.酸式滴定管 B.碱式滴定管 C.量筒(10 mL) D.锥形瓶 E.胶头滴管 F.漏斗 G.250 mL容量瓶
-
(3) 加入锌粉的目的是
-
(4) 步骤3滴定时是否选择指示剂(是或否);说明理由写出步骤3中发生反应的离子方程式
-
(5) 在步骤2中,若加入的KMnO4溶液的量不够,则测得的铁含量(填“偏低”、“偏高”或“不变”);实验测得该晶体中结晶水的个数x为。
 配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定
配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定 标准溶液。下列说法错误的是( )
标准溶液。下列说法错误的是( )
 标准溶液置于锥形瓶中
B . 应选用配带塑料塞的容量瓶配制
标准溶液置于锥形瓶中
B . 应选用配带塑料塞的容量瓶配制 标准溶液
C . 应选用烧杯而非称量纸称量
标准溶液
C . 应选用烧杯而非称量纸称量 固体
D . 达到滴定终点时溶液显橙色
固体
D . 达到滴定终点时溶液显橙色



