pH的简单计算 知识点
pH的简单计算:根据PH的计算公式PH=-lgC(H+)进行计算,注意C(H+)是溶液中的氢离子的浓度,对于酸溶液来说,溶液中的氢离子主要来自酸电离出的氢离子,对于碱来说,利用KW=C(H+).C(OH-)进行计算氢离子的浓度,然后利用pH的公式进行计算。
pH的简单计算 知识点题库
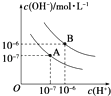
已知水在25℃(A)和T℃(B)时,其电离平衡曲线如图所示:

-
(1) 25℃时,将pH=3 的H2SO4溶液与pH=10的NaOH溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为.
-
(2) T℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 .
-
(3) 曲线B对应温度下,pH=3的HCl溶液和pH=9的某碱溶液等体积混合后,混合溶液的pH=7.请分析其原因:.
下列说法正确的是( )
A . 室温下,0.001 mol•L﹣1的醋酸中由水电离的c(H+)=10﹣11mol•L﹣1
B . Na2CO3溶液中存在c(Na+)+c(H+)═c(OH﹣)+a c(X)+b c(Y),若X为HCO3﹣ , 则b=2
C . 某温度下,浓度均为0.01mol•L﹣1的盐酸和氢氧化钠溶液的pH分别为2和12
D . 向0.1mol•L﹣1氯化铵溶液滴加几滴浓盐酸,c(NH4+)减小,PH增大
常温下,将0.1mol•L﹣1氢氧化钠溶液与0.06mol•L﹣1硫酸溶液等体积混合,该混合溶液的pH等于( )
A . 1.7
B . 2.0
C . 12.0
D . 12.4
完成下列各小题:
-
(1) 某温度下,纯水中C(H+)=2.0×10﹣7 mol•L﹣1 , 则此溶液中的C(OH﹣)=.
若温度不变,滴入稀盐酸使C(H+)=5.0×10﹣6 mol•L﹣1 , 则此时溶液中的C(OH﹣)=.
-
(2) 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42﹣刚好沉淀完全时,溶液的pH7(填>、<、=),离子反应总方程式为:;
向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全时,溶液的pH7(填>、<、=),离子反应总方程式为:.
-
(3) 盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性.试用离子方程式表示该盐碱地产生碱性的原因为:,用化学方程式表示石膏能降低其碱性的反应原理为:.
现有pH=2的醋酸甲和pH=2的盐酸乙:
-
(1) 取10mL的甲溶液,加入等体积的水,醋酸的电离平衡(填“向左”、“向右”或“不”)移动,若加入少量的冰醋酸,醋酸的电离平衡(填“向左”、“向右”或“不”)移动,若加入少量无水醋酸钠固体,待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将(填“增大”、“减小”或“无法确定”).
-
(2) 相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为pH(甲) pH(乙)(填“大于”、“小于”或“等于”,下同).若将甲、乙两溶液等体积混合,溶液的pH=
-
(3) 各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲) V(乙).
-
(4) 取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO﹣)的大小关系为c(Na+) c(CH3COO﹣).
现有常温下pH=2的盐酸甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
-
(1) 取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),醋酸的电离平衡(填“向左”、“向右”或“不”)移动;常温下,另取10mL的乙溶液,加水稀释过程中,下列表达式的数据一定增大的是.
A.c(H+) B.
 C.c(H+)•c(OH﹣) D.
C.c(H+)•c(OH﹣) D. 
-
(2) 取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)( 填“>”、“<”或“=”).
-
(3) 已知25℃时,两种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数K1
1.8×10﹣5
4.3×10﹣7
3.0×10﹣8
K2
﹣﹣
5.6×10﹣11
﹣﹣
下列四种离子水解程度最大的是 .
A . HCO3﹣ B . CO32﹣ C . ClO﹣ D . CH3COO﹣ -
(4) 常温下,取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=.
25℃时,向V mL pH=a的稀硫酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中2c( SO42﹣)=c(Na+),则a+b的值是( )
A . 13
B . 14
C . 15
D . 不能确定
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
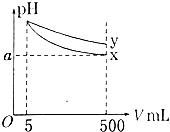
A . x是强碱,y是弱碱
B . 若x、y是一元碱,则等物质的量浓度的x的硝酸盐溶液的pH比y的硝酸盐溶液大
C . 若x、y是一元碱,室温下pH=11的x、y两种碱溶液的浓度相同
D . 完全中和x、y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
甲溶液的pH是4,乙溶液的pH是5,甲溶液与乙溶液的c(H+)之比为( )
A . 10:1
B . 1:10
C . 2:1
D . 1:2
常温下,将0.1mol•L﹣1氢氧化钠溶液与0.06mol•L﹣1硫酸溶液等体积混合,该混合溶液的pH等于( )lg2=0.3.
A . 1.7
B . 2.0
C . 12.0
D . 11.7
下列叙述正确的是( )
A . 95℃纯水的pH<7,说明加热可导致水呈酸性
B . pH=3的醋酸溶液稀释至10倍后pH=4
C . 0.2 mol/L的盐酸与0.1 mol/L的盐酸等体积混合后pH=1.5
D . 若向氨水中加入等浓度稀盐酸至溶液正好呈中性,则所用稀盐酸的体积一定小于氨水的体积
常温下,现有体积相同、pH均为2的盐酸和醋酸溶液,下列说法不正确的是( )
A . 盐酸中的c(Cl﹣)与醋酸溶液中的c(CH3COO﹣)相等
B . 分别与足量CaCO3反应,放出的CO2一样多
C . 分别用水稀释相同倍数,n(Cl﹣)<n(CH3COO﹣)
D . 分别将两溶液升温至80℃,醋酸溶液的pH变小,盐酸的pH不变(不考虑挥发)
25℃时,在①0.01mol/L的盐酸,②pH=2的醋酸,③pH=12的氨水,④0.01mol/L的NaOH溶液4种溶液中,由水电离出的c(H+)的大小关系是( )
A . ②>①>④>③
B . ①=②=③=④
C . ②=③>①=④
D . ②<①<③<④
25℃时,有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液.下列说法不正确的是( )
A . 若将四种溶液稀释100倍,稀释后溶液pH大小顺序:③>④>②>①
B . 等体积的③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④
C . 等体积的②和③混合生成强酸弱碱盐,混合后溶液呈酸性
D . 等体积的①和②分别与足量的锌粒反应生成的氢气在同温同压下体积:①>②
-
(1) 常温下,已知0.1mol·L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8 , 则溶液的pH=。
①pH=3的HA与pH=l1的NaOH溶液等体积混合;反应的离子方程式为;混合溶液中,各离子的物质的量浓度大小关系是 ;
②0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):c(H+)+ c(HA)- c(OH-)= mol·L-1 。
-
(2) t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=。
①该温度下(t℃),将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=;
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是。
有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4 ④NaHSO4
-
(1) 若四种溶液的物质的量浓度相同,其c(H+)最大的是(用序号表示,下同)。
-
(2) 若四种溶液的c(H+)相同,其物质的量浓度最大的是。
-
(3) 将pH相同的上述四种溶液与Zn反应生成等量氢气,所需时间最短的是。
-
(4) 将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1 , 此温度下醋酸的电离常数Ka=,(写出计算式,不必计算最终结果)。温度升高,Ka将(填“变大”、“不变”或“变小”)。
-
(5) 在常温下将pH=11的NaOH溶液a L与pH=2的H2SO4溶液b L混合,若混合后溶液呈中性,则a:b=。
常温下,pH=12的强碱溶液与pH=2的强酸溶液混合,(体积变化忽略不计)所得混合液的pH=11,则强碱与强酸的体积比是( )
A . 11:1
B . 9:11
C . 1:11
D . 11:9
-
(1) 常温下,2L pH=12的Ba(OH)2溶液的物质的量浓度为,从中取出10mL加水稀释到100mL,pH=。
-
(2) 已知500mLAl2(SO4)3溶液中含有Al3+为0.5mol,则Al2(SO4)3溶液的物质的量浓度为mol/L,取上述溶液50mL加水到150mL,此溶液中SO42-的物质的量浓度为mol/L。
下列说法正确的是( )
A . 体系的内能与温度等有关,只要温度不变,体系的内能不变
B . 反应 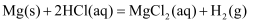 能自发进行,它的
能自发进行,它的  ,
,  C . 室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后,所得溶液的pH大于7
D . 水与丙酮能完全互溶的原因是两种分子间能形成氢键
C . 室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后,所得溶液的pH大于7
D . 水与丙酮能完全互溶的原因是两种分子间能形成氢键
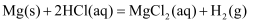 能自发进行,它的
能自发进行,它的  ,
,  C . 室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后,所得溶液的pH大于7
D . 水与丙酮能完全互溶的原因是两种分子间能形成氢键
C . 室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后,所得溶液的pH大于7
D . 水与丙酮能完全互溶的原因是两种分子间能形成氢键
下列说法正确的是( )
A . 0.1 mol∙L−1CH3COOH加水稀释,溶液中c(OH-)减小
B . 相同浓度的HCl和CH3COOH,两溶液中c(H+)相同
C . 等浓度的CH3COOH与KOH以任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
D . 甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的c(H+)之比为10:1
最近更新



