氢氧化铝的制取和性质探究 知识点题库
某同学探究氨和铵盐的性质,相关实验操作及现象描述正确的是( )
A . 室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱
B . 将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性
C . 将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟
D . 加热除去NH4Cl中的少量NaHC03
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl-与SO42-之比为( )

A . 2:3
B . 1:3
C . 3:2
D . 2:1
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是( )

A . a点对应的溶液中:Na+、AlO2-、SO42-、NO3-
B . b点对应的溶液中:Ba2+、K+、NO3-、Cl-
C . c点对应的溶液中:Na+、Ag+、Mg2+、NO3-
D . d点对应的溶液中:Cl-、NO3-、Fe2+、Na+
下列各图与表述一致的是( )
![]()

A . 图①表示A,B两物质的溶解度随温度变化情况,将t1℃时A,B饱和溶液分别升温至t2℃时,溶质的质量分数B>A
B . 用图②所示装置蒸发FeCl3溶液制备无水FeCl3
C . 图③可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化
D . 图④电解饱和食盐水的装置中,溶液B为浓氢氧化钠溶液
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解” 现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2; ②向 NaAlO2溶液中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液; ④向硅酸钠溶液中逐滴加入过量的盐酸
A . ①②
B . ①③
C . ①④
D . ②③
下列各组物质能相互反应得到Al(OH)3的是()
A . Al与NaOH溶液共热
B . AlCl3与过量的NaOH溶液
C . Al2O3与水共热
D . Al2(SO4)3与过量氨水
关于 Al(OH)3的叙述错误的是( )
A . 是两性氢氧化物
B . 是难溶于水的白色胶状物质,是弱电解质
C . 既溶于氢氧化钠溶液、氨水,又能溶于盐酸、醋酸
D . 能凝聚水中悬浮物,可用做净水剂
溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物貭的量之向的关系如图所示。则下列説法正确的是( )
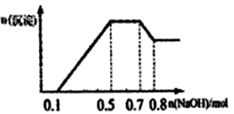
A . 溶液中的阳离子一定含有H+、Mg2+、Al3+ , 可能含有Fe3+
B . 溶液中一定不含CO32-和NO3- , 一定含有SO42-
C . 溶液中C(NH4+)=0.2mol/L
D . c(H+):c(Al3+):c(Mg2+)=l:1:1
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示。则:

-
(1) 写出代表各线段发生反应的离子方程式:①OD段,②DC段。
-
(2) 原溶液中Mg2+、Al3+物质的量浓度之比为。
-
(3) 图中C点表示当加入molNaOH时,Al3+已经转化成(填离子符号)。
-
(4) 图中线段OA:AB=。
根据要求完成下列化学方程式或离子方程式。
-
(1) 利用铝热反应焊接钢轨的化学方程式为。
-
(2) 实验室利用二氧化锰和浓盐酸制取氧气的化学方程式为。
-
(3) 乙醇与金属钠反应的化学方程式为。
-
(4) 苯与浓硫酸和浓硝酸混合液共热制取硝基苯的化学方程式为。
-
(5) 氯化铝溶液与氨水制备氢氧化铝的离子方程式为。
下列实验现象描述正确的是( )
| 选项 | 实验 | 现象 |
| A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
| C | 向Al2(SO4)3溶液中滴加过量NaOH溶液 | 产生大量白色沉淀 |
| D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A . A
B . B
C . C
D . D
甲、乙两烧杯中分别装有相同体积、相同物质的量浓度的氨水和NaOH溶液,各加入10mL0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是( )
A . 甲中沉淀一定比乙中的多
B . 甲中沉淀可能比乙中的多
C . 甲中和乙中的沉淀不可能一样
D . 甲中沉淀一定比乙中的少
使溶液中的Al3+完全转化成Al(OH)3 , 应选择的最好试剂是( )
A . NH3·H2O
B . HCl
C . NaOH
D . CO2
实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,最适宜选用的试剂是( )
A . NaOH溶液
B . Ba(OH)2溶液
C . 盐酸
D . 氨水
常温下,将一定量的钠铝合金置于水中,合金全部溶解,并放出氢气,得到 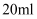
 的溶液,然后用
的溶液,然后用 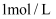 的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法错误的是( )
的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法错误的是( )
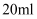
 的溶液,然后用
的溶液,然后用 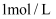 的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法错误的是( )
的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法错误的是( ) 
A . 原合金质量为 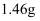 B . 产生氢气的体积为
B . 产生氢气的体积为 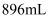 (标准状况下)
C . 图中
(标准状况下)
C . 图中 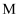 的值为1.56
D . 图中
的值为1.56
D . 图中  为100
为100
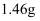 B . 产生氢气的体积为
B . 产生氢气的体积为 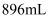 (标准状况下)
C . 图中
(标准状况下)
C . 图中 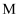 的值为1.56
D . 图中
的值为1.56
D . 图中  为100
为100
下列有关物质的制备说法正确的是( )
A . 将SiO2加入水中,可以获得硅酸胶体
B . 加热氯化铵固体,可以制取氨气
C . 向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体
D . 向硫酸铝溶液中,加氢氧化钠溶液至过量可以获得Al(OH)3沉淀
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A . NaCl(aq)  NaHCO3(s)
NaHCO3(s)  Na2CO3
B . Al(s)
Na2CO3
B . Al(s)  Al2O3(s)
Al2O3(s)  Al(OH)3
C . AgNO3(aq)
Al(OH)3
C . AgNO3(aq)  [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)  Ag(s)
D . MgCO3(s)
Ag(s)
D . MgCO3(s)  MgCl2(aq)
MgCl2(aq)  Mg(s)
Mg(s)
 NaHCO3(s)
NaHCO3(s)  Na2CO3
B . Al(s)
Na2CO3
B . Al(s)  Al2O3(s)
Al2O3(s)  Al(OH)3
C . AgNO3(aq)
Al(OH)3
C . AgNO3(aq)  [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)  Ag(s)
D . MgCO3(s)
Ag(s)
D . MgCO3(s)  MgCl2(aq)
MgCl2(aq)  Mg(s)
Mg(s)
下列实验操作对应的现象正确的是( )
| 选项 | 实验操作 | 实验现象 |
| A | 用湿润的蓝色石蕊试纸检验甲烷与氯气在光照条件下反应后的混合气体 | 石蕊试纸不变色 |
| B | 向酸性高锰酸钾溶液中通入足量的乙烯 | 溶液的紫色逐渐褪去 |
| C | 向AlCl3溶液中滴加过量氨水 | 溶液中先出现白色沉淀后溶解 |
| D | 向FeCl3溶液中滴加KSCN溶液 | 溶液中出现血红色沉淀 |
A . A
B . B
C . C
D . D
下列实验操作、现象及结论都正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将红热的碳放入浓硫酸中,产生的气体通入澄清的石灰水中 | 石灰水变浑浊 | 碳被浓硫酸氧化成 CO2 |
| B | 向NaAlO2溶液中滴入NaHCO3溶液 | 有白色沉淀生成 | AlO2-结合H+的能力比 |
| C | 将常温下用冷的浓硝酸处理过的铝片插入硫酸铜溶液中 | 铝片表面无明显现象 | 用硝酸处理后,铝的金属性减弱 |
| D | 向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
A . A
B . B
C . C
D . D
下列各组中的两种物质发生反应:①铁与硫酸;②AlCl3与氨水;③NaOH与CO2;④SO2与O2。因反应物用量、浓度不同而能生成不同产物的是( )
A . ①②
B . ②④
C . ①③
D . ③④
最近更新
 强
强


