亚硝酸盐 知识点
亚硝酸盐 知识点题库
-
(1) 下列方法中,不能用来区分NaNO2和NaCl的是 (填序号).
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI﹣淀粉溶液来区别 D. 用AgNO3和HNO3两种试剂来区别
-
(2) 人体正常的血红蛋白含有Fe2+ . 若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是 (填序号).
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
-
(3) Fe与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要求产物纯净,可选用的最佳试剂是 (填序号).
A.Cl2 B.Fe C.H2O2 D.HNO3
-
(4) 某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3﹣和Mn2+ , 请写出反应的离子方程式:
-
(5) 已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是
-
(1) 上述反应中氧化剂是 . 氧化产物是 (填写化学式)
-
(2) 根据上述反应,鉴别NaNO2、NaCl.可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有 (填序号).
-
(3) 某厂废液中,含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 (填编号).
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
-
(4) 化学方程式:10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O.若反应过程中转移5mole﹣ , 则生成标准状况下N2的体积为 L.
-
(1) )人体正常的血红蛋白含有Fe2+ , 若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是 (填字母编号).
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
-
(2) )下列方法中,不能用来区分NaNO2和NaCl的是 (填字母编号).
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI﹣淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别
-
(3) )单质铁与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,将Fe2+转化为
Fe3+ , 要求不引入新的杂质,可选用的最佳试剂是 (填字母编号).
a.Cl2 b.Fe c.H2O2 d.HNO3
-
(4) 某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出该反应的离子方程式:
-
(1) 人体正常的血红蛋白含有Fe2+ , 若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是 (填字母编号).
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
-
(2) 下列方法中,不能用来区分NaNO2和NaCl的是 (填字母编号).
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI﹣淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别
-
(3) 单质铁与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要求不引入新的杂质,可选用的最佳试剂是 (填字母编号).
a.Cl2 b.Fe c.H2O2 d.HNO3
-
(4) 某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出该反应的离子方程式:
-
(1) 下列方法中,不能用来区分NaNO2和NaCl的是 (填序号).
A.测定这两种溶液的pH B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI﹣淀粉溶液来区别 D.分别在两种溶液中滴加甲基橙
-
(2) Fe与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要求产物纯净,可选用的最佳试剂是 (填序号).
A.Cl2 B.H2O2 C.KMnO4 D.HNO3
-
(3) 某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3﹣和Mn2+ , 请写出反应的离子方程式:
-
(4) 已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是

-
(1) 下列方法中,不能用来区分NaNO2和NaCl的是 (填序号).A . 测定这两种溶液的pH B . 分别在两种溶液中滴加甲基橙 C . 在酸性条件下加入KI﹣淀粉溶液来区别 D . 用AgNO3和HNO3两种试剂来区别
-
(2) 人体正常的血红蛋白含有Fe2+ . 若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是 (填序号).A . 亚硝酸盐被还原 B . 维生素C是还原剂 C . 维生素C将Fe3+还原为Fe2+ D . 亚硝酸盐是还原剂
-
(3) Fe与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要求产物纯净,可选用的最佳试剂是 (填序号).A . Cl2 B . Fe C . H2O2 D . HNO3
-
(4) 某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3﹣和Mn2+ , 请写出反应的离子方程式:.
-
(5) 已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是.
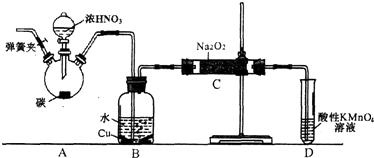
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2═HNO3+2NO↑+H2O;
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
-
(1) A中反应的化学方程式是
-
(2) B中观察到的主要现象是,D装置的作用是
-
(3) 经检验C产物中亚硝酸钠含量较少.
a.甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠.
生成碳酸钠的化学方程式是.为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称).
b.乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是.
-
(4) 实验经改进后可制得较纯亚硝酸钠,下列关于亚硝酸钠的说法正确的是
a.亚硝酸钠有咸味,可代替食盐食用
b.常温下,0.1mol/L亚硝酸钠溶液pH>1
c.0.1mol/L亚硝酸钠溶液中存在:c(Na+)+c(H+)=c(NO2﹣)+c(OH﹣)
d.0.1mol/L亚硝酸钠溶液中存在:c(NO2﹣)>c(Na+)>c(OH﹣)>c(H+)
-
(1) I.制备NaNO2
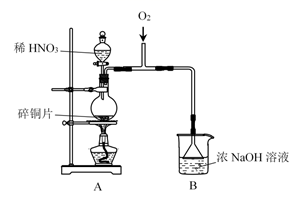
A中发生反应的化学方程式是。
-
(2) B中选用漏斗替代长直导管的优点是。
-
(3) 为检验B中制得NaNO2 , 甲进行以下实验:
序号
试管
操作
现象
①
2 mLB中溶液
加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液
不变蓝
②
2 mLB中溶液
滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液
变蓝
③
2 mLH2O
滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液
不变蓝
实验③的目的是。
-
(4) 乙认为上述3组实验无法证明B中一定含NaNO2 , 还需补充实验,理由是。
-
(5) II.探究NaNO2的性质
装置
操作
现象

取10 mL1 mol/LNaNO2溶液于试剂瓶中,加入几滴H2SO4酸化,再加入10 mL1 mol/LFeSO4溶液,迅速塞上橡胶塞,缓缓通入足量O2。
i.溶液迅速变为棕色;
ii.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色。
iii.最终形成棕褐色溶液。
资料:i.[Fe(NO)]2+在溶液中呈棕色。
ii.HNO2在溶液中不稳定,易分解产生NO和NO2气体。
溶液迅速变为棕色的原因是。
-
(6) 已知棕色溶液变浅是由于生成了Fe3+ , 反应的离子方程式是。
-
(7) 最终棕褐色溶液的成分是Fe(OH)x(SO4)y , 测得装置中混合溶液体积为20 mL,设计如下实验测定其组成。
资料:充分反应后,Fe2+全部转化为Fe(OH)x(SO4)y。
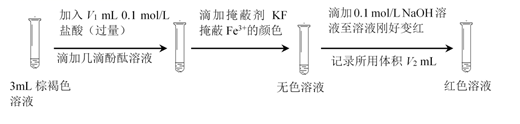
Fe(OH)x(SO4)y中x=(用含V1、V2的代数式表示)。
资料:Ag+与NO  反应,可生成AgNO2白色沉淀或无色配离子。
反应,可生成AgNO2白色沉淀或无色配离子。
-
(1) Ⅰ. NaNO2的制取(夹持装置略)
实验i
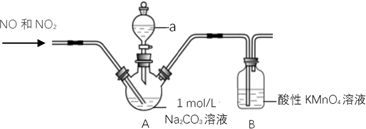
向装置A中通入一段时间N2 , 再通入NO和NO2混合气体,待Na2CO3反应完全后,将所得溶液经系列操作,得到NaNO2白色固体。
仪器a的名称是。
-
(2) 制取NaNO2的离子方程式是。
-
(3) 小组成员推测HNO2是弱酸。为证实推测,向NaNO2溶液中加入试剂X,“实验现象”证实该推测合理,加入的试剂及现象是。
-
(4) Ⅱ. NaNO2性质探究
将实验ⅰ制取的NaNO2固体配制成约0.1 mol/L NaNO2溶液,进行实验ⅱ和ⅲ。
实验ii
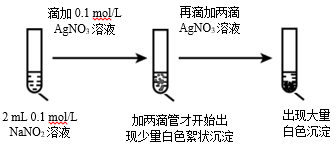
①由实验ⅱ的现象得出结论:白色沉淀的生成与有关。
②仅用实验ⅱ的试剂,设计不同实验方案进一步证实了上述结论,实验操作及现象是。
-
(5) ① 酸性条件下,NO
 氧化I-的离子方程式是。
氧化I-的离子方程式是。 实验iii
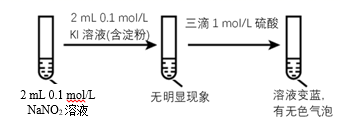
②甲同学认为,依据实验ⅲ的现象可以得出结论:该条件下,NO
 能氧化I-。乙同学则认为A装置中制取的NaNO2含有副产物,仅凭实验ⅲ不能得出上述结论,还需要补充实验iv进行验证,乙同学设计实验iv证明了实验ⅲ条件下氧化I-的只有NO
能氧化I-。乙同学则认为A装置中制取的NaNO2含有副产物,仅凭实验ⅲ不能得出上述结论,还需要补充实验iv进行验证,乙同学设计实验iv证明了实验ⅲ条件下氧化I-的只有NO  ,实验iv的实验方案是。
,实验iv的实验方案是。
-
(1) NaOH是实验室中最常用的试剂之一。实验室进行某实验需要0.3mol·L-1的氢氧化钠溶液约460mL,根据溶液配制的过程,回答下列问题:
①实验除了需要托盘天平(带砝码)、药匙、烧杯、胶头滴管和玻璃棒外,还需要的其他玻璃仪器是;
②根据计算得知,需用托盘天平(带砝码)准确称量NaOH固体g;
③配制NaOH的操作可分解成如下几步,以下正确的操作顺序是;
A.继续往容量瓶中小心地加蒸馏水,使液面接近刻线
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.将已冷却的溶液注入已检查不漏水的容量瓶中
D.根据计算,用天平称量一定质量的NaOH固体
E.将NaOH固体在烧杯中溶解
F.盖上容量瓶塞子,反复上下颠倒,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹液面恰好与刻线相切
④由于不正确操作,所配制NaOH溶液浓度偏小的是。
A.转移时有少量溶液洒到容量瓶外面
B.使用容量瓶配制溶液时,俯视定容后所得溶液的浓度
C.没有用蒸馏水洗涤烧杯玻璃棒2~3次
D.容量瓶刚用蒸馏水洗净,没有烘干
E.定容时,不小心加水使液面高于刻线后,再吸出少量水使凹液面与刻度线相切
-
(2) Na2O2可作为呼吸面具和潜水艇里氧气的来源。Na2O2作为供氧剂时与人体呼出的水蒸气发生反应的化学方程式为。
-
(3) 亚硝酸钠(化学式NaNO2)因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应: 2NaNO2+4HI=2↑+I2+2NaI+2H2O,回答问题:
①上述反应中,根据元素守恒,横线上的物质化学式是。
②实验表明亚硝酸钠溶液呈碱性,亚硝酸银是一种白色不溶于水的固体。亚硝酸银与稀硝酸反应的化学方程式为:AgNO2+HNO3(稀)=AgNO3+HNO2 , 其中HNO2不稳定分解:HNO2=NO↑(无色)+NO2↑(红棕色)+H2O。请结合以上信息设计实验鉴别亚硝酸钠和食盐两瓶失去标签的固体。(提示:实验所需试剂和仪器均可提供,请写出操作、现象、结论)。



