氨的性质及用途 知识点题库
-
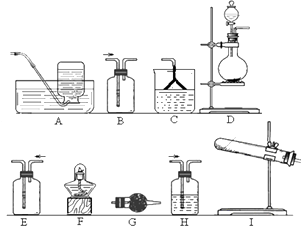
(1) 该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气.
①应该选用的仪器及装置有(填字母).
②生石灰与氯化铵反应生成氨气的化学方程式为
-
(2) 该小组同学设计如图所示装置探究氨气的还原性.
在上述过程会同时发生多个反应,写出其中属于置换反应的化学方程式.若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为.
-
(3) 该小组同学以氨气和二氧化碳为原料制备碳酸氢铵.
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳.合适的方案是(填“甲”或“乙”),原因是.
②检验产物中有NH
 的方法为.
的方法为.

-
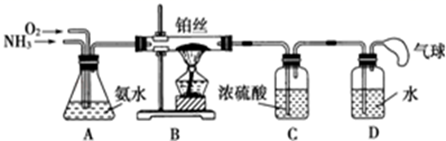
(1) A中反应的化学方程式是.
-
(2) B中的干燥剂是.
-
(3) C中的现象是.
-
(4) 实验进行一段时间后,挤压D装置中的胶头滴管,滴入1﹣2滴浓盐酸,可观察到的现象是.
-
(5) 为防止过量氨气外逸,需要在上述装置的末端增加一个尾气处理装置,应选用的装置是(填“E”或“F”).
-
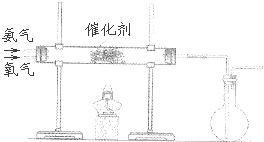
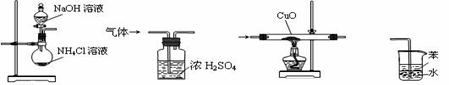
(1) 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.则制取氮气的装置为(从图A、B、C中选择,下同),制取氢气的装置为.
-
(2) 甲装置的作用除了使气体充分混合外,还有①、②.
-
(3) 乙装置发生反应的化学方程式为.其中催化剂为Fe粉,它能否用Fe2O3代替?.说明理由..
-
(4) 丙装置吸收一段时间氨气后,再通入空气,同时将经加热的铂丝插入到锥形瓶内,可观察到:有红棕色气体和白烟生成,请用化学方程式说明催化氧化后,产生以上现象的原因:;,.
 B . 验证Cu与浓硝酸反应的热量变化
B . 验证Cu与浓硝酸反应的热量变化 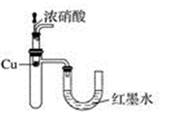 C . 验证NH3易溶于水
C . 验证NH3易溶于水 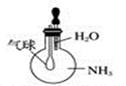 D . 比较Na2CO3与NaHCO3的稳定性
D . 比较Na2CO3与NaHCO3的稳定性 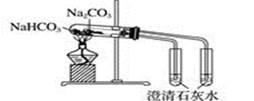
甲 乙 丙 丁
-
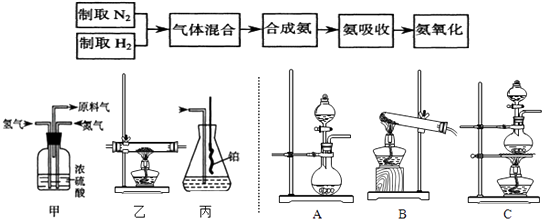
(1) 实验室制备NH3 , 下列方法中适宜选用的是(填序号)。
①固态氯化铵与熟石灰混合加热
②固态氯化铵加热分解
③碱石灰中滴加浓氨水
④氯化铵溶液与氢氧化钠溶液共热
-
(2) 装置B中发生反应的化学方程式为;
-
(3) 装置C的作用是;装置C中的现象;为确保装置D中尽可能多地生成HNO3 , 所通入O2和NH3的体积比应大于;
-
(4) 装置D中发生的反应化学方程式为。(请分步写出化学方程式)
-
(1) 硫酸铵是某地PM2.5雾霾的主要成分,收集一定量的雾霾固体进行验证。取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份盛于试管中:
操作步骤
实验现象
结论
①向其中一份
有白色沉淀生成
证明雾霾固体中含有SO42-
②向另一份中加适量NaOH浓溶液并加热,用镊子夹持湿润的红色石蕊试纸靠近试管口
③试管中有气泡产生,靠近试管口的红色石蕊试纸
证明雾霾固体中含有NH4+。综合上面实验,初步说明雾霾固体颗粒中含有(NH4)2SO4
-
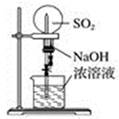
(2) 用如图所示简易装置测定空气中SO2的含量。
①测定原理:SO2通入碘的淀粉溶液中,溶液由蓝色变为无色,反应的化学方程式为。
②测定方法:在某监测点,量取5.0mL5.0×10-4mol/L的碘溶液,注入图中的试管中,加几滴淀粉指示剂,此时溶液呈蓝色,按图中装置连接好仪器,利用止水夹控制,进行抽气,取下注射器排气,重复操作直到溶液的蓝色全部褪尽为止,共抽取空气8.0L,则测得该监测点空气中SO2的含量为mg/L。
-
(3) 探究H2SO3的部分性质。选用下面的装置和药品探究H2SO3与HClO的酸性强弱。
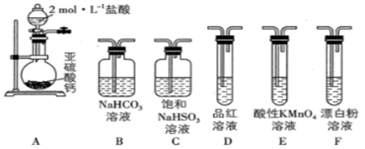
①甲同学认为按照A→C→F→尾气处理的顺序连接装置,可以证明H2SO3与HClO的酸性强弱,乙同学认为该方案不合理,其理由是。
②丙同学采用间接法证明,实验方案为按照A→C→→→→(填字母)→尾气处理顺序连接装置,证明H2SO3的酸性强于HClO的实验现象是。
![]()
-
(1) 若A为硫单质,B为无色且有刺激性气味的有毒气体,则D是(填化学式),B→C的化学反应方程式为。
-
(2) 若A为气态氢化物,B为无色气体,C为一种红棕色气体,则A是(填化学式),A→B的化学反应方程式为。
 的喷泉实验说明氨气极易溶于水
的喷泉实验说明氨气极易溶于水



