过氧化氢 知识点题库
选项 | 物质 | 用途 | 解释 |
A | H2O2 | 食品漂白剂 | H2O2具有强氧化性,能漂白食品 |
B | SiO2 | 计算机芯片 | SiO2是一种良好的半导体 |
C | Fe3O4 | 红色涂料 | Fe3O4是一种红色氧化物 |
D | 浓H2SO4 | 干燥剂 | 浓H2SO4有脱水性 |
已知H2O2分子的结构如图所示:H2O2分子不是直线型的两个H原子犹如在半展开的书的两线上,氧原子则在书的夹缝上,书页夹角为93°52′,而两个O﹣H键与O﹣O键的夹角均为96°52′.
试回答:
(1)写出H2O2分子的电子式;
(2)写出分子内的键型;
(3)它难溶于CS2 , 简要说明原因;

-
(1) H2O2含有的共价键类型为
-
(2) H2O2能与水任意比混合,且纯净的H2O2具有较高的沸点,这可能与H2O2与水以及H2O2分子间能形成 有关.
-
(3) 实验室可用稀硫酸与BaO2反应来制取H2O2 , 该反应的化学方程式为
-
(4) 经测定H2O2为二元弱酸,酸性比碳酸还弱,不稳定易分解.已知Na2O2中通入干燥的CO2不反应,但通入潮湿的CO2却可以产生O2 , 试用化学方程式表示这一过程
-
(5) 现有一份H2O2溶液,某学习小组想测定其浓度,查阅资料得知方法如下:用移液管吸取10.00mL的H2O2样品,置于100mL)容量瓶中,加水稀释至刻度线,取25.00mL溶液置于锥形瓶再加入10mL 3mol/L的稀硫酸(过量),用0.02mol/L的标准浓度的KMnO4溶液滴定,所用体积为20.00mL,则上述滴定过程发生的离子反应方程式为 ,原H2O2溶液的浓度为 g/L.

-
(1) 图1中仪器①的名称为,该装置中发生的化学方程式为.图1装置也可以用于实验室制气体为(只填一种即可).
-
(2) 小杨同学将MnO2与水泥按一定比例加水混合、凝固,制作成小块状固体,加入图2装置中制氧气,以方便实验结束回收二氧化锰.实验前检查该装置气密性的方法为:其中块状固体应放置在处(填“A”或“B”).
-
(3) Cu与稀硫酸不能直接反应,但滴加H2O2溶液并加热,能生成水和一种蓝色溶液.则该反应的化学方程式为.
 白色沉淀
白色沉淀  白色沉淀不溶解,则试样中一定有SO42﹣
D . 不慎将浓盐酸洒在桌上,应立即用浓NaOH溶液冲洗
白色沉淀不溶解,则试样中一定有SO42﹣
D . 不慎将浓盐酸洒在桌上,应立即用浓NaOH溶液冲洗
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:

A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E.净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
-
(1) 蒽醌法制备双氧水理论上消耗的原料是,循环使用的|原料是,配制工作液时采用有机溶剂而不采用水的原因是。
-
(2) 氢化釜A中反应的化学方程式为,进入氧化塔C的反应混合液中的主要溶质为。
-
(3) 萃取塔D中的萃取剂是,选择其作萃取剂的原因是。
-
(4) 工作液再生装置F中要除净残留的H2O2 , 原因是。
-
(5) 双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为mol/L。

 的分子结构与
的分子结构与  相似,如下图所示。下列有关说法错误的是( )
相似,如下图所示。下列有关说法错误的是( ) 
 是极性分子
B .
是极性分子
B .  分子中所有原子均满足8电子稳定结构
C .
分子中所有原子均满足8电子稳定结构
C .  分子中既含有极性键又含有非极性键
D .
分子中既含有极性键又含有非极性键
D .  的相对分子质量比
的相对分子质量比  大,熔、沸点高
大,熔、沸点高
 是一种无毒无害的新型漂白剂和氧化剂。下列说法错误的是( )
是一种无毒无害的新型漂白剂和氧化剂。下列说法错误的是( )
-
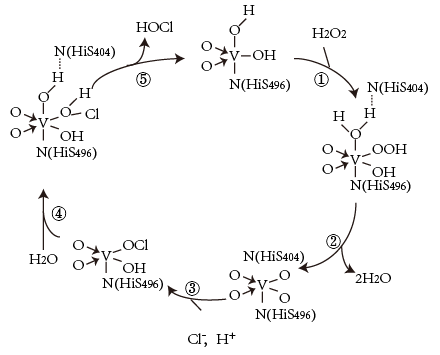
(1) H2O2在Fe3O4催化剂表面产生HO除去废水中的苯酚的原理如图-1所示。
①酸性条件下,该催化过程中产生HO的反应的离子方程式为。
②在不同初始pH条件下,研究苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是。
-
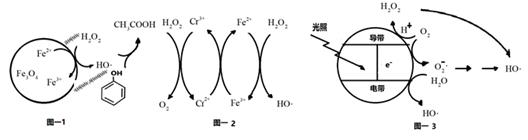
(2) 掺杂了Cr3+的Fe3O4催化剂催化氧化原理如图-2所示。在Fe3O4催化剂中掺杂少量Cr3+ , 可提高催化效率,但浓度太高,反而会降低催化效率,其原因是。
-
(3) 光催化氧化技术也可生成HO降解有机污染物。其原理如图-3.光照时,价带失去电子产生有强氧化性的空穴。价带上生成HO的电极反应式为。图中,HO还有另外的产生途径,描述其产生过程:。
 B . 硫酸铜溶液中加少量的铁粉:
B . 硫酸铜溶液中加少量的铁粉: C . 酸性碘化钾溶液中滴加适量双氧水:
C . 酸性碘化钾溶液中滴加适量双氧水: D . 二氧化硫与酸性高锰酸钾溶液反应:
D . 二氧化硫与酸性高锰酸钾溶液反应:
 的喷泉实验说明氨气极易溶于水
的喷泉实验说明氨气极易溶于水
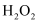 是一种氧化剂,其溶液常用作漂白剂和消毒剂,室温下会分解成水和氧气,但分解速度极其慢,催化剂作用下反应速度加快。利用废蚀刻液(含
是一种氧化剂,其溶液常用作漂白剂和消毒剂,室温下会分解成水和氧气,但分解速度极其慢,催化剂作用下反应速度加快。利用废蚀刻液(含 、
、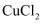 及
及 )制备碱性刻液
)制备碱性刻液 溶液和
溶液和 的主要步骤:用
的主要步骤:用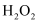 氧化废蚀刻液,通入氨气,制备碱性蚀刻液
氧化废蚀刻液,通入氨气,制备碱性蚀刻液 , 固液分离,用盐酸溶解沉淀并制备
, 固液分离,用盐酸溶解沉淀并制备 , 下列有关
, 下列有关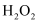 说法正确的是( )
说法正确的是( )
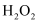 是由非极性共价键构成的非极性分子
B . 酸性
是由非极性共价键构成的非极性分子
B . 酸性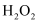 溶液氧化
溶液氧化 的离子方程式:
的离子方程式: C . 氧化废蚀刻液时,
C . 氧化废蚀刻液时,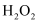 适当过量的主要原因是
适当过量的主要原因是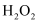 部分催化分解
D .
部分催化分解
D . 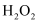 能使酸性高锰酸钾溶液褪色,说明具有漂白性
能使酸性高锰酸钾溶液褪色,说明具有漂白性
-
(1) 试分析H2O2能用作绿色消毒剂的原因。
-
(2) 纯H2O2相对稳定,实验表明在54℃下恒温储存两周,在MnO2催化下迅速分解。写出实验室用H2O2分解制氧气的化学反应方程式。
-
(3) 一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。
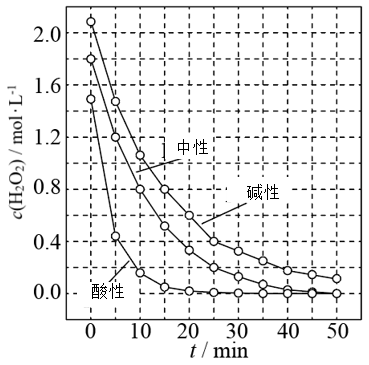
①单位时间的浓度变化量可以表示分解速率。中性时,0~10min H2O2的H2O2浓度变化量=mol/L。
②以下对图像的分析正确的是(选填序号)。
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,中性时H2O2的分解百分率比酸性时大
-
(4) Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O(过氧化钙),该产物是一种大水产养殖中广泛使用的供氧剂。其化学反应方程式为:Ca(OH)2+H2O2+6H2O=CaO·8H2O。
①反应时通常加入过量的Ca(OH)2 , 其目的是。
②向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有(填序号)。
A.Ca2+B.H+C.CO
 D.OH-
D.OH-



