过氧化氢 知识点题库
 白色沉淀
白色沉淀 白色沉淀不溶解,则试样中一定有SO42﹣
D . 不慎将浓盐酸洒在桌上,应立即用浓NaOH溶液冲洗
白色沉淀不溶解,则试样中一定有SO42﹣
D . 不慎将浓盐酸洒在桌上,应立即用浓NaOH溶液冲洗
a、H2O2+2Fe3+=2Fe2++O2↑+2H+ b、H2O2+2Fe2++2H+=2Fe3++2H2O.
在以上反应中Fe3+实际上起着 作用
(2)I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:
a、H2O2+I2=2HIO;b、 .
(3)在硫酸和KI的混合溶液中加入足量的H2O2 , 生成可使淀粉变蓝色的棕色溶液,并放出无色气体.写出该过程中可能发生的化学方程式: .
(4)配平化学方程式,氧化铁在碱性溶液中与硝酸钠反应制备铁酸钠:
Fe2O3+ NaNO3+ NaOH→ Na2FeO4+ NaNO2+ H2O.
根据上述材料,回答下列问题:
-
(1) 依据你已有的知识,写出H2O2的结构式 .你认为H2O2被称为绿色氧化剂的主要原因是:
-
(2) S2Cl2的分子结构与H2O2类似,电子式为 ,属 分子(填极性或非极性).
-
(3) H2O2是一种二元弱酸,其电离方程式为: 它与过量的Ba(OH)2反应的化学方程式为:
-
(4) H2O2还有一定的还原性,能使酸性KMnO4溶液褪色,其离子反应方程式为
-
(5) 我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:
-
(6) 下列物质不会使过碳酸钠失效的是 .A.MnO2B.H2SC.CH3COOH D.NaHCO3 .
-
(1) 化学方程式为
-
(2) 对H2O2及分解反应的说法不正确的是
A.H2O2分子中含有极性键和非极性键 B.CuSO4、FeCl3和唾液都可作该反应的催化剂
C.该反应在无催化剂时,不能够反应 D.H2O2与酸性高锰酸钾反应可生成O2
-
(3) 已知lg MnO2加入20mL溶液里(ρ=1g•mL﹣1),2min时,反应刚好结束,共产生标准状况下的气体44.8mL,该溶液浓度为 mol/L,反应速率v(H2O2)为 mol/(L•min)
-
(4) 若把H2O2看成是二元弱酸,请写出它在水中的第一步电离方程式
它作为酸与强碱Ba(OH)2反应形成盐的化学方程式
序号 | 甲 | 乙 |
A | 二氧化锰 | 过氧化氢溶液 |
B | 氢氧化钠和碳酸钠混合溶液 | 稀盐酸 |
C | 氯化钠和氢氧化钙的混合溶液 | 碳酸钠溶液 |
D | 氯化铁和氯化铜溶液 | 氢氧化钠溶液 |

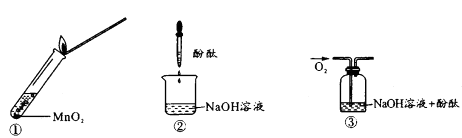

-
(1) 硬铬尖晶石中,Cr的化合价为。
-
(2) 在步骤II中除去的离子是,操作X的名称为。
-
(3) 写出步骤III中H2O2表现的性质是,已知步骤III所得溶液c(Cr3+)=0.010mol/L,常温下,加NaOH使c(Fe3+)和c(Al3+)均降至10-5mol/L,应控制溶液的pH为。(常温下:[Ksp[Cr(OH)3]=1.0×10-32 , Ksp[Al(OH)3]=1.0×10-35 , Ksp[Fe(OH)3]=1.0×10-38]。
A.10~11 B.>11 C.约为10 D.约为4
-
(4) 已知NaBiO3和Bi(OH)3都是难溶于水的固体。在步骤IV中发生化学反应的离子方程式为,步骤V中CO2压强越大Na2Cr2O7产率越高,其原因是。
-
(5) 工业上用电解法制备铬,其装置示意图如图:

电解池工作时,阴极发生的电极反应式为,该装置的电能主要转变为能。
| 选项 | 操作 | 现象 | 结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
| B | 向 KCl、KI 的混合液中逐滴滴加稀 AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 铝片先用砂纸打磨,再加入到浓硝酸中 | 无明显现象 | 浓硝酸具有强氧化性,常温下,铝表面被浓硝酸氧化为致密的氧化铝薄膜 |
| D | 向盛有 H2O2 溶液的试管中加入几滴酸化的硫酸亚铁溶液 | 溶液变成棕黄色,一段时间后溶液中出现气泡,随后有红褐色沉淀生成 | Fe3+催化 H2O2 分解产生 O2 |
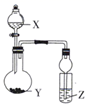
| 选项 | X | Y | Z | Z实验现象或结论 | 装置 |
| A | 稀硫酸 | 亚硫酸钠 | 品红溶液 | SO2能氧化品红 | |
| B | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 | |
| C | 浓盐酸 | 石灰石 | 硅酸钠溶液 | 非金属性:C>Si | |
| D | 稀硫酸 | 硫化亚铁 | 硫酸铜溶液 | 无明显现象,弱酸不能制强酸 |
①用于消毒的酒精、“84”消毒液、双氧水、过氧乙酸(CH3COOOH)等均属于有机物
②95%的酒精比75%的酒精杀菌效果好
③“84”消毒液露置在空气中不会变质
④双氧水能使酸性高锰酸钾溶液和溴水褪色,其褪色原理均为氧化还原反应
⑤修建“火神山”医院所用的HDPE(高密度聚乙烯)膜是一种无毒、无味的高分子材料
⑥医用外科口罩和防护服所用的熔喷布是一种聚丙烯材料,聚丙烯可以使溴水褪色
⑦科研人员积极研发抗击新型冠状病毒的疫苗,疫苗一般应冷藏存放,以避免蛋白质变性
⑧N95口罩用0.3µmNaCl颗粒进行测试,阻隔率达95%以上,戴N95口罩可有效阻隔PM2.5
⑨过氧乙酸和乙酸属于同系物
-
(1) 在同浓度Fe3+的催化下,探究浓度对H2O2分解反应速率的影响。实验装置如图所示:
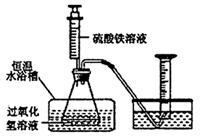
①写出H2O2溶液在Fe3+催化下分解的化学方程式;除了图中所示仪器之外,该实验还必需的仪器是。
②请写出下面表格中I、II、III的实验记录内容或数据:
实验序号
0.1mol/LFe2(SO4)3溶液的体积/mL
II
30%H2O2溶液的体积/mL
蒸馏水的体积/mL
O2的体积/mL
1
I
b
c
d
e
2
a
b
d
III
f
I=,II=,III=。
-
(2) 利用图1和图2中的信息,按图3装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到A瓶中气体颜色比B瓶中的(填“深”或“浅”),其原因是。
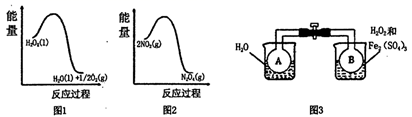
-
(3) 该小组预测同为第四周期VIII族的Fe、Co、Ni可能有相似的催化作用。查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知法制取得到的催化剂活性更高,推测Co2+、Ni2+两种离子中催化效果更好的是。

| 目的 | 操作 | |
| A | 证明FeCl3和KSCN溶液反应可逆 | 将同浓度的KSCN和FeCl3溶液等体积混合后再滴加少量KSCN液观察溶液颜色变化 |
| B | 证明酸性:碳酸>苯酚 | 将硝酸溶液与NaHCO3混合产生的气体直接通入苯酚钠溶液 |
| C | 证明Ksp(AgCl)>Ksp(AgBr) | 向含有相同Cl-和Br-浓度的溶液中滴加少量AgNO3溶液 |
| D | 证明H2O2具有强氧化性 | 向 |

选项 | ①中的物质 | ②中的物质 | 预测②中的现象 |
A | 氯水 | 石蕊溶液 | 溶液变成红色 |
B | 双氧水 | 二氧化锰 | 无明显现象 |
C | 稀硫酸 | 碳酸钠溶液 | 开始没有气泡,一段时间后才产生气泡 |
D | 浓盐酸 | 二氧化锰 | 立即产生黄绿色气体 |



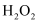 C . 该过程中1mol微粒含电子数为18NA的粒子有3种
D . 反应过程中每一步反应Pd元素的化合价均发生了变化
C . 该过程中1mol微粒含电子数为18NA的粒子有3种
D . 反应过程中每一步反应Pd元素的化合价均发生了变化
 H2O2溶液中滴加
H2O2溶液中滴加 


