浓硫酸的性质 知识点题库

A | B | C | D |
|
|
|
|
放电闪电时会发生反应:N2+O2═2NO | 利用丁达尔效应证明烧杯中的分散系是胶体 | 蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 | 加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
选项 | A | B | C | D |
物质 | 浓硫酸 | 酒精 | 汽油 | 氯酸钾 |
标签 |
|
|
|
|
-
(1) 浓硫酸滴在木条上,过一会儿,木条变黑.
-
(2) 敞口放置浓硫酸时,质量增加..
试通过计算和推理完成下面的问题:
-
(1) SO2物质可以使酸性KMnO4溶液褪色,此反应中(填写化学式)失去电子.
-
(2) 足量的铜片与 含溶质1.8mol的浓H2SO4充分反应,如果该反应过程中转移了 0.2mol电子,生成的CuSO4的质量为克,生成的气体在标准状况下体积为升(假设气体全部逸出).
-
(3) 将反应后所得到的溶液与足量Ba(OH)2溶液充分反应.请写出此过程发生的反应的离子方程式:.
| 选项 | 操 作 | 结 论 |
| A | 火柴梗分别蘸取两溶液 | 变黑者为浓硫酸 |
| B | 取两溶液少许于试管中,分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
| C | 取适量两溶液分别加入到盛水的试管中 | 放热者为浓硫酸 |
| D | 取两溶液少许分别加入到CuSO4·5H2O晶体中 | 晶体变白者为浓硫酸 |

-
(1) 沸腾炉中发生反应的化学方程式为4FeS2+11O2
 2Fe2O3+8SO2 , 该反应被氧化的元素是(填元素名称)。
2Fe2O3+8SO2 , 该反应被氧化的元素是(填元素名称)。
-
(2) 利用Fe2O3废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的化学方程式为。
-
(3) 从接触室出来的混合气体中含有SO2、SO3、O2、N2等气体,设计一个实验方案证明其中含有SO2:。
-
(4) 有些反应中物质浓度不同,性质也不同。浓硫酸有三大特性:吸水性、脱水性、强氧化性。则加热时浓硫酸与木炭反应的化学方程式为。
-
(5) 将一定量锌与100mL18mol/L 浓硫酸充分反应后,若锌完全溶解同时产生气体0.8mol, 将反应后的溶液稀释得400mL,测得c(H+)=2mol/L,则产生气体中SO2 物质的量为mol。
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | Cu片与足量浓硫酸加热反应,冷却后,再将冷水缓慢加入盛有反应混合物的烧杯中 | 溶液变蓝 | 证明反应生成了Cu2+ |
| B | 取少量某溶液于试管中,加入NaOH浓溶液并加热,用湿润的蓝色石蕊试纸检验产生的气体 | 蓝色石蕊试纸变红 | 溶液中含有NH4+ |
| C | 向20.00mL浓度均为0.01mol/L的Na2SO4和Na2S 的混合溶液中滴加几滴等浓度的AgNO3溶液 | 只产生黑色沉淀Ag2S | Ksp(Ag2S)<Ksp(Ag2SO4) |
| D | 室温下,用pH试纸分别测定浓度均为0.1mol/L的Na2SO3和Na2CO3两种溶液的pH | pH: Na2CO3>Na2SO3 | 非金属性:S>C |

查阅资料:
I.磺酰氯遇水会发生水解反应,生成两种强酸:一种含氧酸、一种无氧酸。
II.磺酰氯在室温下较稳定,但在100℃以上时便会分解产成SO2和Cl2。
III.磺酰氯的熔点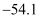 ℃、沸点69.1℃;H2SO4的熔点10.4℃、沸点338℃,不易分解。
℃、沸点69.1℃;H2SO4的熔点10.4℃、沸点338℃,不易分解。
回答下列问题:
-
(1) 磺酰氯中硫元素的化合价为价;仪器B的名称是。
-
(2) 图甲A中的黑色固体是(填化学式);图乙B中发生反应的化学方程式为。
-
(3) 装置的组装顺序是a→→→,b→→→:仪器组装完毕后,进行实验前要先。
-
(4) C中的试剂为。戊中“气球”的作用是。
-
(5) 若缺少装置丙和丁,戊中所得产物反应的化学方程式为。
-
(6) 磺酰氯也可用氯磺酸(ClSO3H)分解获得,反应原理为:
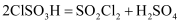 。
。①要从产物(假定氯磺酸已分解完全,下同)中获得纯净的磺酰氯,可采用的方法是;
②请设计实验证明该方法获得的产物中含有H2SO4:(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液)。
物质 用途 A.浓硫酸——————a.作干燥剂 B.二氧化硫 b.作红色颜料 C.碳酸氢铵 c.作漂白剂 D.氧化铁 d.作膨松剂 E.氨气 e.作制冷剂 |
 可与NaOH溶液反应,也可与氢氟酸反应,说明
可与NaOH溶液反应,也可与氢氟酸反应,说明 为两性氧化物
D . Fe与稀
为两性氧化物
D . Fe与稀 、稀
、稀 反应均有气泡产生,说明Fe与两种酸均发生了置换反应
反应均有气泡产生,说明Fe与两种酸均发生了置换反应
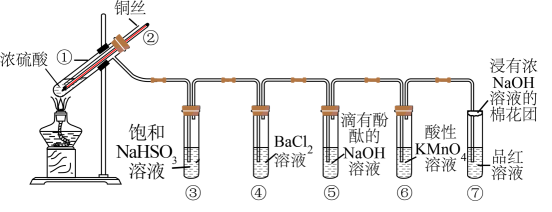
-
(1) 试管①中发生反应的化学方程式为;其中硫酸发生了(填“氧化”或“还原”)反应。
-
(2) 一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2具有、、漂白性。
-
(3) 下列说法正确的是(填字母)。
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物
 , 可立刻向试管①中加水,观察颜色
, 可立刻向试管①中加水,观察颜色 -
(4) 充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中
 变大的是(填字母)。
变大的是(填字母)。a.
 b.
b. c.
c.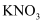
-
(5) 反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为。











