硫化氢 知识点题库
关于硫化氢气体在空气中完全燃烧的产物,下列叙述正确的是( )
①具有臭鸡蛋气味的气体
②是淡黄色的固体
③是无色有刺激性气味的气体
④是造成酸雨的主要物质.
A . ②
B . ③
C . ①④
D . ③④
在氢硫酸溶液中加入少量下列物质:①O2;②Cl2;③SO2;④CuSO4 . 能使溶液pH值减小的是( )
A . ①③
B . ②④
C . ②③④
D . ①
某气体能使紫色石蕊试液变红,能使酸性高锰酸钾溶液褪色,若通入溴水,可使溶液变浑浊.该气体是( )
A . CO2
B . Cl2
C . H2S
D . SO2
近期,北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用.下列叙述正确的是( )
A . 硫化氢分子很稳定,受热难分解
B . 硫化氢分子中所有原子的最外电子层都达到8电子结构
C . 将硫化氢通入溴水,溴水褪色
D . 硫化氢是电解质,其电离方程式是:H2S⇌2H++S2﹣
下列有关硫化氢气体叙述正确的是( )
A . 无色无味气体
B . 可用向下排空气法收集
C . 不能用排水法收集
D . 无毒无害
下列有关说法中错误的是( )
A . 硫化氢的水溶液叫氢硫酸,易被氧化
B . SO2是一种有刺激性气味的有毒气体,易溶于水,是亚硫酸的酸酐
C . pH在5.6~7.0之间的降水通常称为酸雨
D . 推广使用低硫煤,并向煤中加生石灰的方法,可减少SO2的排放
将﹣定量的H2S气体通入400mL0.5mol/L的NaOH溶液中,然后在低温下蒸发溶液,得到白色固体A.推测白色固体A的所有可能组成① ;② ;③ ;④ (用化学式填)
已知H2S 有可燃烧性,燃烧时氧气的量不同,产物也不同.
-
(1) 在标准状况下,H2S和O2 的混合气体120mL,经点燃后,反应至完全,所得气体经干燥后,恢复到原来状况,体积为15mL,该15mL气体可能是
A.H2S和SO2 B.O2 C.H2S D.SO2和O2
-
(2) 若标准状况下,上述气体,H2S和O2 的混合气体120mL,经点燃后,反应至完全,所得气体经干燥后,恢复到原来状况,体积为30mL,求原气体可能的组成
-
(3) 已知硫化氢气体在空气中的体积分数为4.3%~45.5%时点燃会发生爆炸,当硫化氢在空气中的体积分数为20%时,其爆炸产物是
-
(4) 在标准状况下,将120mL H2S和O2的混合气体点燃,若原混合气体中H2S 为x mL,反应后所得气体的总体积为y mL,求:
①当x在不同范围时y与x的函数关系.
②当y=60mL时,原H2S 的体积可能是多少
硫及其主要的化合物在化学研究及生产生活中都有重要的应用.
-
(1) 硫的气态氢化物H2S是一种臭鸡蛋气味的气体,写出它的电子式,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明还H2S有强的性.
-
(2) 硫单质在一定条件下能与硫化钠反应分别生成多硫化钠(与Na2O2结构相似),反应方程式为:Na2S+(x﹣1)S=Na2Sx
①Na2Sx中所合化学键的类型有.
②已知向多硫化钠溶液中滴加稀盐酸,溶液变浑浊,且有臭鸡蛋气昧的气体生成,写出发生反应的离子方程式:
-
(3) 硫代硫酸钠(Na2S2O3)俗名叫大苏打,在中学化学实验中利用它和稀硫酸的反应探究温度对化学反应速率的影响.
①写出Na2S2O3与稀硫酸反应的化学方程式:.
②S2O32﹣有很强的配位能力,照相底片上未曝光的溴化银在定影液(含Na2S2O3)中由于形成一个配位数为2的配离子而溶解,该配离子的化学式为:
-
(4) 锅炉水垢中的硫酸钙因难溶于酸而很难清洗,通常采取的方法为先用饱和碳酸钠溶液处理,再用稀盐酸除去;写出用饱和碳酸钠溶液处理时发生反应的离子方程式:.
物质的类别和其中所含核心元素的化合价研究物质性质的两个重要角度。请根据下图所示,回答下列问题。

-
(1) X的化学式是,将Na2S2O3填入上图中。
-
(2) 检验Y所用的试剂是,Y易引起的环境问题是,用NaOH溶液处理含Y的废气,发生反应的离子方程式是。
-
(3) W的浓溶液与铜反应的化学方程式是。
W的稀溶液与铜不发生反应的原因是。
对比这两个事实可以得出的结论是。
-
(1) 将下列现象中硫酸表现出来的性质填写在空格内:敞口放置的浓硫酸,溶液质量增加;浓硫酸与蔗糖放出大量热,并出现黑色固体;
-
(2) 将一瓶二氧化硫和一瓶硫化氢气体瓶口对接进行混合,瓶壁上能观察到有和生成,其化学反应方程式为: , 此反应中SO2作剂, 1 mol 二氧化硫和硫化氢完全反应时,有mol电子发生转移。
-
(3) 当雨水的pH时,我们称之为“酸雨”。某环保小组测定某次雨水中硫酸的物质的量浓度为5×10-6 mol/L,这次雨酸雨(选填“属于”或“不属于”)。常温下若把0.1mol/L的盐酸溶液稀释100倍,此时的溶液的pH=。
-
(4) 将一充满氨气的大试管倒立在水槽中,可以看到现象,说明,若在此溶液中滴入酚酞试液,溶液呈色,其电离方程式。
已知反应:①2H2S+O2=2S+2H2O;②2H2S+SO2=3S+2H2O;③2H2S+3O2=2SO2+2H2O,将点燃的H2S气体的导管伸入盛有一定量O2的集气瓶内,上述3个反应发生的先后顺序是 ( )

A . ①②③
B . ③①②
C . ①③②
D . ③②①
有下体气体:①SO2 ②H2S ③H2 ④CO2 ⑤NH3不能用浓H2SO4干燥的是( )
A . ①②
B . ②⑤
C . ①②④
D . ①③⑤
下列叙述中,不正确是( )
A . 自然界中的硫都是以化合态存在的
B . 硫既具有氧化性,又具有还原性
C . 硫化氢气体具有可燃性
D . 附着在试管内壁的硫,可以用CS2洗涤
用下列装置验证SO2的某些性质(加热及夹持装置略去)。

-
(1) 装有浓硫酸的仪器名称是。
-
(2) 铜与浓硫酸反应的化学方程式是。
-
(3) 能验证SO2具有氧化性的实验现象是。
-
(4) 装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是,。
-
(5) 写出SO2显示还原性并生成白色沉淀的总的离子方程式。
-
(6) 能验证SO2具有酸性氧化物的通性的实验现象。若通入过量的SO2 , 则其总反应的离子反应方程式是。
天然气是一种重要的化工原料和燃料,常含有少量H2S。一种在酸性介质中进行天然气脱硫的原理示意图如图所示。下列说法正确的是( )

A . 脱硫过程中Fe2(SO4)3溶液的pH逐渐减小
B . CH4是天然气脱硫过程的催化剂
C . 脱硫过程需不断补充FeSO4
D . 整个脱硫过程中参加反应的n(H2S):n(O2)=2:1
下列反应不能生成黄色固体的是( )
A . 氯气通入碘化钾溶液中
B . 金属钠在空气中燃烧
C . 碘水滴入硝酸银溶液中
D . 硫化氢气体通入亚硫酸中
天然气是应用广泛的燃料,但含有少量的H2S气体。在酸性溶液中利用硫杆菌可实现天然气的脱硫,其原理如图所示,下列说法正确的是( )

A . 过程甲中的离子方程式为:  B . FeSO4为该脱硫过程的催化剂
C . 过程乙中每4molFe2+参加反应,需消耗22.4L的O2
D . 脱硫过程中O2间接氧化H2S
B . FeSO4为该脱硫过程的催化剂
C . 过程乙中每4molFe2+参加反应,需消耗22.4L的O2
D . 脱硫过程中O2间接氧化H2S
 B . FeSO4为该脱硫过程的催化剂
C . 过程乙中每4molFe2+参加反应,需消耗22.4L的O2
D . 脱硫过程中O2间接氧化H2S
B . FeSO4为该脱硫过程的催化剂
C . 过程乙中每4molFe2+参加反应,需消耗22.4L的O2
D . 脱硫过程中O2间接氧化H2S
某元素的价类二维图如图所示。常温常压下,A是一种具有臭鸡蛋气味的气体,组成单质X的元素为地壳中的含量最高的元素,Y是一种常见的无色无味的液体,Z为碱且其焰色试验为黄色。

按要求回答下列问题∶
-
(1) 写出下列物质的化学式∶D;E 。
-
(2) 用电子式表示A的形成过程∶。
-
(3) 将C通入A的水溶液中,可观察到的现象为。
-
(4) G转化为F的化学方程式为。
硫化氢的转化是资源利用和环境保护的重要研究课题。将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收
的混合溶液中回收 , 其转化如下图所示(
, 其转化如下图所示( 不溶于水)。下列说法中,错误的是( )
不溶于水)。下列说法中,错误的是( )
 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收
的混合溶液中回收 , 其转化如下图所示(
, 其转化如下图所示( 不溶于水)。下列说法中,错误的是( )
不溶于水)。下列说法中,错误的是( )
A . 过程①中,生成 的反应为
的反应为 B . 过程②中,
B . 过程②中, 作氧化剂
C . 过程③中,各元素化合价均未改变
D . 回收S的总反应为
作氧化剂
C . 过程③中,各元素化合价均未改变
D . 回收S的总反应为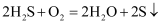
 的反应为
的反应为 B . 过程②中,
B . 过程②中, 作氧化剂
C . 过程③中,各元素化合价均未改变
D . 回收S的总反应为
作氧化剂
C . 过程③中,各元素化合价均未改变
D . 回收S的总反应为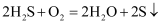
最近更新



