硫化氢 知识点题库
最近我国科学家研究发现人体中微量的H2S能有效预防心脏病、老年性痴呆症.下列有关H2S的说法正确的是( )
A . H2S属于非电解质
B . 人体内H2S可由含硫蛋白质降解产生
C . 大量吸入H2S对人体无害
D . H2S只有还原性没有氧化性
在氢硫酸溶液中,通入或加入少量的下列物质:①O2;②Cl2;③SO2;④CuSO4;⑤NH3能使溶液的导电能力增强的是( )
A . ①②③
B . ②④⑤
C . ①④⑤
D . ②③④
酸性条件下,可用某些盐溶液吸收水煤气中的少量H2S,以回收硫元素、降低污染.欲达到该目的,下列试剂中最合适的是( )
A . KClO3
B . FeCl2
C . HNO3
D . FeCl3
在一定条件下,将70ml硫化氢气体和90ml氧气混合,点燃并使其反应,再恢复到原来的条件,则生成的SO2气体的体积为( )
A . 70mL
B . 60mL
C . 50mL
D . 55mL
硫化氢作为继NO和CO之后的第3种气体信号分子在血管新生的调控中起到重要作用,人体中微量的H2S能有效预防心脏病,下列有关说法正确的是( )
A . H2S属于非电解质
B . NO和CO都属于酸性氧化物
C . H2S只有还原性没有氧化性
D . H2S、NO和CO都能与臭氧反应
脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源
-
(1) 硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为
-
(2) 用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式为 (忽略氧的氧化还原);该方法的优点是
-
(3) 一定温度下,1mol NH4HS固体在定容真空容器中可部分分解为硫化氢和氨气.①当反应达平衡时p氨气×p硫化氢=a Pa2 , 则容器中的总压为 ;
-
(4)
如图是上述反应过程中生成物浓度随时间变化的示意图.若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线.

下列物质发生化学反应时,在不同条件下,可得到不同产物的是( )
①P+Cl2②P2O5+H2O③H2S+O2④Na+O2 .
A . 只有①②
B . 只有③④
C . 只有②③④
D . 全部
下列有关物质的组成、性质、用途的说法.正确的是( )
①Na2O2中的阳离子和阴离子个数比为1:1
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④NO2 , Fe(OH)3 , FeCl2都能直接通过化合反应制备
⑤H2S能使酸性高锰酸钾溶液褪色.所以它具有漂白性.
A . ②③④
B . ①②③
C . ①②③④
D . ①②③⑤
下列有关化学反应过程或实验现象的解释中,正确的是( )
A . Fe(OH)3胶体中加入Na2SO4溶液后有红褐色沉淀生成,说明胶体是不稳定的分散系
B . H2S能与CuSO4溶液反应生成H2SO4 , 说明氢硫酸的酸性比硫酸强
C . 向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D . 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )
A . SO2和H2S
B . Cl2和CO2
C . NH3和CO2
D . SO2和Cl2
硫化氢中的硫元素化合价为,在化学反应中易(填得或失)电子,因此具有性。硫化氢可燃,氧气充足情况下,硫化氢燃烧产生淡蓝色火焰,化学方程式;氧气不足情况下,硫化氢燃烧化学方程式。
科学家发现微量硫化氢可以调节心血管功能。有关硫化氢的叙述正确是( )
A . 硫化氢不稳定,受热易分解
B . 硫化氢是无色无味并且有毒的气体
C . 硫化氢分子中所有原子的最外电子层都达到8电子稳定结构
D . 硫化氢能溶于水形成一种弱酸,其电离方程式是H2S  2H+ + S2-
2H+ + S2-
 2H+ + S2-
2H+ + S2-
硫化氢通入下列溶液中,不会产生浑浊现象的是( )
A . 溴水
B . 盐酸
C . 亚硫酸
D . 高锰酸钾溶液
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
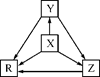
| 选项 | X | Y | Z | R |
| A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
| B | Na | Na2O | Na2O2 | NaOH |
| C | H2S | S | SO2 | SO3 |
| D | N2 | NH3 | NO | NO2 |
A . A
B . B
C . C
D . D
氢硫酸暴露在空气中常常会产生浑浊的现象,是因为( )
A . 挥发作用
B . 被氧化成了单质硫
C . 产生了硫化物沉淀
D . 水蒸发了
常温下,下列实验能发生化学反应,却始终无明显现象的是( )
A . 向FeSO4溶液中通入NO2
B . 向浓硫酸溶液中加入铜片
C . 向NaHCO3溶液中通入NH3
D . 向H2S溶液中通入SO2
将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法错误的是( )

A . 过程①发生非氧化还原反应
B . 过程②中,发生反应为S2-+Fe3+=S+Fe2+
C . 过程③中,氧气是氧化剂
D . 整个转化过程中Fe3+可以循环使用
我国科学家研究了活性炭催化条件下煤气中的H2S和Hg的协同脱除,部分反应机理如图(吸附在催化剂表面的物种用*标注)。有关该过程的叙述错误的是( )

A . 产生清洁燃料H2
B . H2S 脱除率为100%
C . H2S既被氧化又被还原
D . 脱Hg反应为Hg+S= HgS
硫化氢(H2S)是一种有害气体,可用多种方法进行脱除。
-
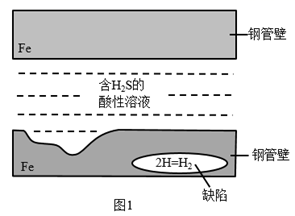
(1) 含H2S的酸性溶液对钢管壁的危害如图1所示,钢管壁内部的缺陷处会积聚H2 , 产生的压力对管壁造成危害。缺陷处产生H2的微观过程可描述为
-
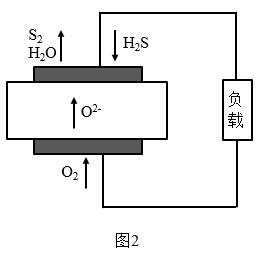
(2) 一种转化H2S的燃料电池工作原理如图2所示。该电池工作时,负极的电极反应式为。
-
(3) 一种脱除H2S回收硫磺工艺的两个阶段主要反应分别如下:
第一阶段:

第二阶段:
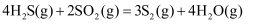
该工艺需控制第一阶段与第二阶段参加反应的H2S的物质的量之比n1(H2S):n2(H2S)约为1:2。若n1(H2S):n2(H2S)过大,会导致。
-
(4) Fe2(SO4)3溶液脱除空气中H2S并再生的原理如图3所示。
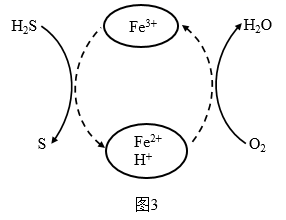
①Fe2(SO4)3溶液脱除空气中H2S的总反应化学方程式为。
②将一定体积含H2S的空气匀速通入Fe2(SO4)3溶液中,反应相同时间,初始Fe3+浓度ρ(Fe3+)及其pH与H2S脱除率的关系如图4所示。当ρ(Fe3+)>10g·L-1 , H2S脱除率下降的原因是。

硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )

A . 在图示的转化中,化合价不变的元素有铜、氯、氢
B . 在图示的转化中,FeCl2、CuCl2未参与化学反应
C . 图示转化的总反应是2H2S+O2 2S+2H2O
D . 当回收得到1mol硫单质时,转移电子的物质的量为2mol
2S+2H2O
D . 当回收得到1mol硫单质时,转移电子的物质的量为2mol
 2S+2H2O
D . 当回收得到1mol硫单质时,转移电子的物质的量为2mol
2S+2H2O
D . 当回收得到1mol硫单质时,转移电子的物质的量为2mol
最近更新



