原子中的数量关系 知识点题库
下列各项表述中正确的是( )
A . Na2O中的Na+和O2-的核外电子排布不相同
B . 106g的乙醇和丙醇混合液完全燃烧生成的CO2为112L(标准状况)
C . 在氮原子中,质子数为7而中子数不一定为7
D . Cl-的结构示意图为 

24g镁原子的最外层电子数为NA (判断对错)
用A质子数、B中子数、C核外电子数填写下列空白(用字母表示)
(1)元素的种类由 决定; (2)原子的种类由 决定
(3)核电荷数由 决定; (4)原子质量由 决定.
在离子RO3n﹣中含有x个核外电子,R原子的质量数为A,则R原子中子数是
根据所学知识完成下面小题:
-
(1) 48g12C18O2分子中的中子数N=mol.
-
(2) S2﹣原子核内有16个中子,其质量数为32,则16gS2﹣所含电子的物质的量为 mol.
-
(3) 某元素的同位素
 X,其氯化物XCl2 . 取1.11gXCl2溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应.若这种同位素原子核内有20个中子,则:①X元素在周期表中的位置.
X,其氯化物XCl2 . 取1.11gXCl2溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应.若这种同位素原子核内有20个中子,则:①X元素在周期表中的位置.
下列微粒中:①12Mg2+②  ③
③  ④O2﹣ , 核外电子总数相同的是( )
④O2﹣ , 核外电子总数相同的是( )
A . ②③④
B . ①②④
C . ①②③
D . ①③④
是否是同种原子决定于原子中所含的( )
A . 电子数
B . 中子数
C . 质子数
D . 质子数和中子数
下列有关原子结构和元素周期律的表述正确的是( )
A . 原子序数为15的元素的最高化合价为+3
B . ⅦA族元素是同周期中非金属性最强的元素
C . 第二周期JVA族元素的原子核电荷数和中子数一定为6
D . I A族元素的金属性一定比ⅡA族元素的金属性强
某元素的一种同位素X 的质量数为A,含N个中子,它与1H 原子组成HmX分子,在ag HmX 中所含质子的物质的量是( )
A . 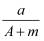 (A-N+m)mol
B .
(A-N+m)mol
B . 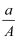 (A-N)mol
C .
(A-N)mol
C . 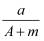 ( A-N)mol
D .
( A-N)mol
D . 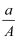 (A-N+m)mol
(A-N+m)mol
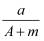 (A-N+m)mol
B .
(A-N+m)mol
B . 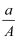 (A-N)mol
C .
(A-N)mol
C . 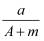 ( A-N)mol
D .
( A-N)mol
D . 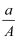 (A-N+m)mol
(A-N+m)mol
据科学家预测,月球的土壤中吸附着数百万吨的  He,每百吨
He,每百吨  He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以 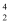 He的形式存在。下列说法正确的是( )。
He的形式存在。下列说法正确的是( )。
 He,每百吨
He,每百吨  He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以 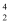 He的形式存在。下列说法正确的是( )。
He的形式存在。下列说法正确的是( )。
A .  He原子核内含有4个质子
B .
He原子核内含有4个质子
B .  He和
He和  He互为同位素
C .
He互为同位素
C .  He原子核内含有3个中子
D .
He原子核内含有3个中子
D .  He的最外层电子数为2,所以
He的最外层电子数为2,所以  He具有较强的金属性
He具有较强的金属性
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A . 常温常压下,19gH3O+含有10NA个电子
B . 4.0gH218O与D2O的混合物中所含中子数为2NA
C . 标准状况下,22.4LCH4和C2H4的混合气体所含氢原子数为4NA
D . 含3.0g HCHO的水溶液中原子总数为0.4NA
某元素原子R的原子核外有16个电子,质量数为34,则原子核里的中子数为( )
A . 32
B . 20
C . 16
D . 18
已知A的原子序数是x,B-与A3+具有相同的电子层结构,则B元素的原子序数为( )
A . x+4
B . x-4
C . x+1
D . x-1
-
(1) I.按要求回答下列问题:
某粒子有1个原子核,核中有17个质子、20个中子,核外有18个电子,该粒子的化学符号是。
-
(2) 写出下列物质的电子式:Mg(OH)2,NH3,Na2O2。
-
(3) 用电子式表示下列化合物的形成过程:Na2S;CO2。
-
(4) Ⅱ.如图为元素周期表的一部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
①
⑥
⑦
②
④
⑤
⑧
③
⑩
⑨
②③④三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是(填化学式)。
-
(5) 10种元素中,简单离子半径最大的是填离子符号)。
-
(6) 元素⑦的简单氢化物与过量的元素⑧的单质反应的化学方程式为。
-
(7) 元素⑩的原子序数为,其单质与水在高温下反应的化学方程式为。
-
(8) 元素①⑦⑧形成的常见化合物的化学式,含有化学键类型、。
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A . CO2 的电子式 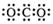 B . 氨气的结构简式 NH3
C . 氯离子的结构示意图
B . 氨气的结构简式 NH3
C . 氯离子的结构示意图  D . 中子数为 20 的氯原子
D . 中子数为 20 的氯原子  Cl
Cl
 Cl
Cl
设  是阿伏加德罗常数的值。下列说法正确的是( )
是阿伏加德罗常数的值。下列说法正确的是( )
 是阿伏加德罗常数的值。下列说法正确的是( )
是阿伏加德罗常数的值。下列说法正确的是( )
A . 18 g重水所含电子的数目为10  B . 所含共价键的数目均为0.6
B . 所含共价键的数目均为0.6  的白磷和甲烷的物质的量相等
C . 常温常压下,46 g
的白磷和甲烷的物质的量相等
C . 常温常压下,46 g  的混合物中含H原子数目为4
的混合物中含H原子数目为4  D . 电解精炼铜时,当电路中通过
D . 电解精炼铜时,当电路中通过  个电子,阳极溶解32 g铜
个电子,阳极溶解32 g铜
 B . 所含共价键的数目均为0.6
B . 所含共价键的数目均为0.6  的白磷和甲烷的物质的量相等
C . 常温常压下,46 g
的白磷和甲烷的物质的量相等
C . 常温常压下,46 g 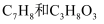 的混合物中含H原子数目为4
的混合物中含H原子数目为4  D . 电解精炼铜时,当电路中通过
D . 电解精炼铜时,当电路中通过  个电子,阳极溶解32 g铜
个电子,阳极溶解32 g铜
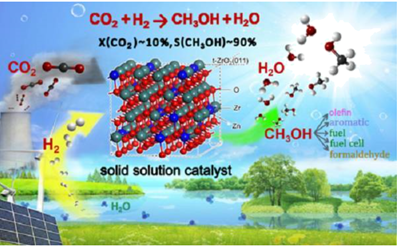
CO2的减排已引起国际社会的广泛关注。近日,中科院大连化物所用一种双金属固溶体氧化物催化剂,实现了CO2合成甲醇(CH3OH),原理示意图如下:
-
(1) 16g CH3OH的物质的量是,含H原子的数目为。
-
(2) 0.2mol H2O中含电子总物质的量为。
-
(3) 标准状况下,H2与CO2混合气体的总质量为9.0g,n(H2):n(CO2)=1:2。
①CO2的质量是。
②H2的体积是。
③混合气体的平均摩尔质量为。
工业上通过Al2O3+N2+3C  2AlN+3CO可制得高温陶瓷材料AlN。下列说法正确的是( )
2AlN+3CO可制得高温陶瓷材料AlN。下列说法正确的是( )
 2AlN+3CO可制得高温陶瓷材料AlN。下列说法正确的是( )
2AlN+3CO可制得高温陶瓷材料AlN。下列说法正确的是( )
A . N2的电子式为:  B . AlN是分子晶体
C . 27Al用原子中的中子数为14
D . 基态氮原子轨道表示式:
B . AlN是分子晶体
C . 27Al用原子中的中子数为14
D . 基态氮原子轨道表示式: 
钼元素为人体及动植物必须的微量元素,也在钢铁工业中有着重要的作用,钼作为钢的合金化元素,可以提高钢的强度,特别是高温强度和韧性。我国钼元素的储量丰富,在世界上占第二位。如图所示是元素周期表中钼元素的相关信息,下列说法不正确的是( )

A .  (钼酸根离子)中共有76个电子
B . 钼元素的相对原子量为95.96
C . 92Mo、95Mo、98Mo互为同位素,化学性质几乎相同
D . 钼元素是第五周期的主族元素
(钼酸根离子)中共有76个电子
B . 钼元素的相对原子量为95.96
C . 92Mo、95Mo、98Mo互为同位素,化学性质几乎相同
D . 钼元素是第五周期的主族元素
 (钼酸根离子)中共有76个电子
B . 钼元素的相对原子量为95.96
C . 92Mo、95Mo、98Mo互为同位素,化学性质几乎相同
D . 钼元素是第五周期的主族元素
(钼酸根离子)中共有76个电子
B . 钼元素的相对原子量为95.96
C . 92Mo、95Mo、98Mo互为同位素,化学性质几乎相同
D . 钼元素是第五周期的主族元素
碳和硅的原子结构中相同的是( )
A . 质子数
B . 核外电子数
C . 最外层电子数
D . 电子层数
最近更新



