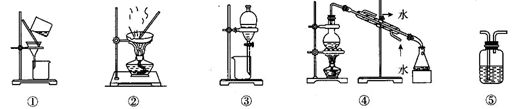
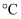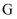过滤 知识点题库

已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大,在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10Ksp(BaCO3)=5.1×10-9
-
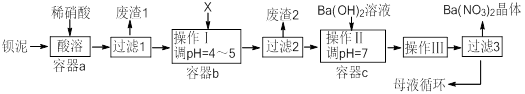
(1) 该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理。
-
(2) 上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为。
-
(3) 结合本厂生产实际,X试剂应选下列中的 。A . BaCl2 B . BaCO3 C . Ba(NO3)2 D . Ba(OH)2
-
(4) 废渣2为。
-
(5) 操作III为。
-
(6) 过滤III后的母液应循环到容器中(选填a、b、c) 。
-
(7) 称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为。

已知:
①醋酸铅易溶于水,难电离。
②常温下,Ksp(PbSO4)=1.6×10-8;Ksp(PbCO3)=8.0×10-14。
回答下列问题:
-
(1) 为了加快①的反应速率,通常选用6mol/L的硝酸和60℃的反应条件,若温度继续升高,反而不利于反应的进行,原因可能是。
-
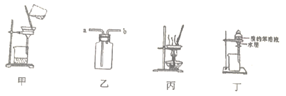
(2) 步骤④若在实验室进行分离操作必需的玻璃仪器有,滤渣1的主要成分是硫酸铅,洗涤硫酸铅最好选用。
A.蒸馏水
B.苯
C.稀硫酸
D.饱和碳酸钠
-
(3) 写出步骤③反应的离子方程式。
-
(4) 采用电解法精炼铅,海绵铅连接电源的极(填正、负),生成铅的电极反应式为。
-
(5) 处理含铅废料1t(含铅以PbO计,质量分数为11.15%),若回收率为90%,则得到的铅质量g。


-
(1) I.上述过程中没有涉及到的四种基本反应类型是;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
-
(2) 步骤 1 中分离操作的名称是;
-
(3) 粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:a.盐酸;
B.BaCl2溶液;
C.NaOH 溶液;
D.Na2CO3 溶液。加入试剂的顺序是;
-
(4) II.实验室利用精盐配制 240mL 2.0mol/LNaCl 溶液。
除烧杯和玻璃棒外,还需要的玻璃仪器有;
-
(5) 用托盘天平称取固体 NaClg;
-
(6) 配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦ 摇匀 ⑧装瓶。操作中还缺少一个重要步骤是;
-
(7) 下列不符合题意操作可使所配制氯化钠溶液浓度偏低的是。
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
e.称量固体的砝码已生锈
①用NaCl固体配制一定物质的量浓度的溶液
②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
③实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
④从含NaCl的溶液中获得蒸馏水 ⑤用CCl4萃取碘水中的碘
NaCl、Na2SO4、NH4HCO3 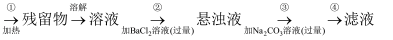

回答下列问题:
-
(1) 操作①的目的是。操作②能否用硝酸钡溶液。(填“能”或“不能”)。
-
(2) 进行操作②后,如何判断SO
 已除尽,方法是。
已除尽,方法是。
-
(3) 操作③中发生反应的化学方程式为。操作④的名称是。
-
(4) 此设计方案是否严密(填“严密”或“不严密”),理由是。
-
(5) 原固体样品中含NaClm1g,最后得到的NaCl固体m2g,则m1m2(填“>”“<”或“=”)。
| 选项 | 物质 | 试剂 | 操作方法 |
| A | | 蒸馏水 | 过滤 |
| B | | | 萃取、分液 |
| C | 乙烷(乙烯) | 酸性 | 洗气、干燥 |
| D | | — | 蒸馏 |
 和少量
和少量  、
、  杂质)为原料制取铵明矾晶体
杂质)为原料制取铵明矾晶体  的一种工艺流程。
的一种工艺流程。 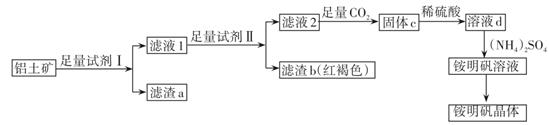
请回答:
-
(1) 试剂Ⅰ为,滤渣a可以“变废为宝”,写出它的一种用途。
-
(2) 证明铁元素已除尽的实验方法是。
-
(3) 滤液2中通入足量
 进行酸化得到固体c,则生成固体c的离子方程式为。
进行酸化得到固体c,则生成固体c的离子方程式为。
-
(4) 由溶液d制取铵明矾溶液的化学方程式为,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、、、干燥(填操作名称)。
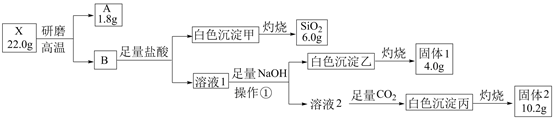
-
(1) 操作①的名称是。
-
(2) 写出白色沉淀丙与氢氧化钠溶液反应的离子方程式是。
-
(3) X的化学式是。
-
(4) 用电子式表示固体1所含物质的形成过程。
 、
、 、
、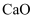 、
、 、
、 等)中回收金属
等)中回收金属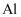 、
、 并制备电池正极材料
并制备电池正极材料 的工艺流程如下图所示:
的工艺流程如下图所示:
已知:① 与
与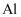 同主族,其化学性质相似。
同主族,其化学性质相似。
②随着温度升高,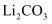 在水溶液中的溶解度减小:
在水溶液中的溶解度减小:
温度/ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/ | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
③本工艺流程中,不同金属离子形成氢氧化物沉淀的 范围如表格所示:
范围如表格所示:
金属离子 | 形成氢氧化物沉淀的 |
| 3.3~10.6 |
| 2.9~9.4 |
回答下列问题:
-
(1) “滤渣1”的成分除了
 之外还含有。
之外还含有。
-
(2) 已知“酸浸”后铁元素以铁配离子(
 )的形式存在,写出
)的形式存在,写出 在该过程中的离子方程式。
在该过程中的离子方程式。
-
(3) “调
 ”步骤中的范围应为,“滤液2”中镓元素的存在形式为。
”步骤中的范围应为,“滤液2”中镓元素的存在形式为。
-
(4) 工业上通过电解法利用“物质
 ”制备
”制备 , 反应的化学方程式为。
, 反应的化学方程式为。
-
(5) “
 ”中的
”中的 元素化合价为,在“电池级
元素化合价为,在“电池级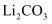 ”转化为“
”转化为“ ”的反应中,氧化剂与还原剂物质的量之比为。
”的反应中,氧化剂与还原剂物质的量之比为。
 B .
B .  C .
C .  D .
D . 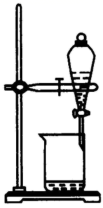
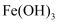 胶体
胶体 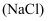
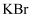 溶液
溶液 

 溶液、浓硫酸
溶液、浓硫酸 固体
固体