气体摩尔体积 知识点题库
用铂电极电解CuCl2与CuSO4的混合溶液(浓度均为2 mol/L)50mL ,当阴极析出9.6g 固体时,阳极析出的气体在标准状况下的体积是( )
A . 3.36L
B . 2.8L
C . 6.72L
D . 4.48L
下列叙述正确的是( )
A . 一定温度、压强下,气体体积由其分子的大小决定
B . 一定温度、压强下,气体体积由气体的物质的量的多少决定
C . 气体摩尔体积是指1 mol 任何气体所占的体积为 22.4 L
D . 不同的气体,若体积不等,则它们所含的分子数一定不相等
标准状况下,下列物质所占体积最大的是( )
A . 98 g H2SO4
B . 6.02×1023 CO2
C . 44.8 L HCl
D . 6 g H2
对一定量气体体积的探究.
已知1 mol不同气体在不同条件下的体积.
化学式 | 条件 | 1mol气体体积 |
H2 | 0℃,101kPa | 22.4 |
O2 | 0℃,101kPa | 22.4 |
CO | 0℃,101kPa | 22.4 |
H2 | 0℃,202kPa | 11.2 |
CO2 | 0℃,202kPa | 11.2 |
N2 | 273℃,202kPa | 22.4 |
NH3 | 273℃,202kPa | 22.4 |
-
(1) 从上表分析得出的结论:①1 mol任何气体在标准状况下的体积都约为.
②1 mol不同的气体,在不同的条件下,体积(填“一定”、“一定不”或“不一定”)相等.
-
(2) 理论依据:相同条件下,1mol任何气体的体积几乎相等,原因是:①,②.
-
(3) 应用:在标准状况下,48g O3的体积为多少升?(写出计算过程)
某气体的摩尔质量为M g/mol,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。则  表示的是( )
表示的是( )
 表示的是( )
表示的是( )
A . V L该气体的质量(以g为单位)
B . 1 L该气体的质量(以g为单位)
C . 1 mol该气体的体积(以L为单位)
D . 1 L该气体的物质的量(以mol为单位)
用NA代表阿伏加德罗常数,下列叙述正确的是( )
A . 78 g Na2O2中含有的离子总数为4NA
B . 标准状况下,1.12LHF中所含的分子总数为0.05 NA
C . 由CO2和O2组成的混合物共有Na个分子,其中的氧原子数为2 NA
D . 0.1 mol • L-1 FeCl3溶液中含有的Cl-数目为0.3 NA
在标准状况下,将1g氦气,11g二氧化碳和4g氧气混合,求该混合气体的体积。
下列叙述正确的是( )
A . 6.02×1023叫做阿伏加德罗常数
B . 摩尔(mol)是国际单位制中七个基本单位之一
C . H2SO4的摩尔质量(M)是98
D . 气体摩尔体积(Vm)是指1 mol任何气体所占的体积都约为22.4 L
由CH4和O2组成的混合气体,标准状况下的密度为1g.L-1 , 则该混合气体中CH4和O2的体积比为( )
A . 2:1
B . 1:2
C . 2:3
D . 3:2
下列说法正确的是()
A . 1mol任何粒子或物质的质量,其数值都与该粒子的相对原子质量或相对分子质量相等
B . 在0℃和101kPa(标准状况)的条件下,1mol任何物质所占的体积约为22.4L
C . 如果1L水中含有1molNaOH,那么这种溶液中NaOH的物质的量浓度就是1mol/L
D . 我们通常把1mol任何粒子的粒子数叫做阿伏加德罗常数
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A . 常温常压下,48g O3含有的氧原子数为3NA
B . 标准状况下,22.4L Cl2与足量的Fe反应转移的电子数为3NA
C . 已知可逆反应:2NO2  N2O4 , 将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
D . 58.5gNaCl固体溶于1L的水中,所得溶液的物质的量浓度为1mol/L
N2O4 , 将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
D . 58.5gNaCl固体溶于1L的水中,所得溶液的物质的量浓度为1mol/L
 N2O4 , 将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
D . 58.5gNaCl固体溶于1L的水中,所得溶液的物质的量浓度为1mol/L
N2O4 , 将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
D . 58.5gNaCl固体溶于1L的水中,所得溶液的物质的量浓度为1mol/L
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 25℃、101kPa 时,22.4L乙烷中所含共价键数目为6NA
B . 3.2gO2和O3的混合气体中,含氧原子数为0.2NA
C . 12g金刚石含有共价键数目为4NA
D . 1molNaHSO4熔融时电离出的离子总数为3NA
下列叙述正确的是( )
A . 1 molH2O的质量为18g/mol
B . 含有3.01×1023个氧原子的SO2分子的质量约为16g
C . CH4的摩尔质量为16g
D . 标准状况下,1mol任何物质体积均为22.4L
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A . 标准状况下,22.4 L H2O含有的原子数为3 NA
B . 常温常压下,1.06 g Na2CO3含有的Na+数目为0.02 NA
C . 5.6g铁粉放入足量稀硫酸中转移的电子数为0.3NA
D . 0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA
阿伏加德罗常数的值为  。下列说法正确的是( )
。下列说法正确的是( )
 。下列说法正确的是( )
。下列说法正确的是( )
A . 1L0.1mol· 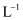 NH4Cl溶液中,
NH4Cl溶液中,  的数量为0.1
的数量为0.1  B . 2.4gMg与H2SO4完全反应,转移的电子数为0.1
B . 2.4gMg与H2SO4完全反应,转移的电子数为0.1  C . 标准状况下,2.24LN2和O2的混合气体中分子数为0.2
C . 标准状况下,2.24LN2和O2的混合气体中分子数为0.2  D . 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2
D . 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2 
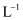 NH4Cl溶液中,
NH4Cl溶液中,  的数量为0.1
的数量为0.1  B . 2.4gMg与H2SO4完全反应,转移的电子数为0.1
B . 2.4gMg与H2SO4完全反应,转移的电子数为0.1  C . 标准状况下,2.24LN2和O2的混合气体中分子数为0.2
C . 标准状况下,2.24LN2和O2的混合气体中分子数为0.2  D . 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2
D . 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2 
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A . 标准状况下,2.24LSO3所含的分子数为0.1NA
B . 1molCu和含2molH2SO4的热浓硫酸反应,失去2 NA个电子
C . 16gO2含有的氧原子数为NA
D . 0.3 mol.L-1的MgCl2溶液中含Mg2+数为0.3 NA
下列说法中正确的是( )
A . H2SO4 的摩尔质量是 98 g
B . 1 mol H2O 的质量是 18 g/mol
C . Cl-的摩尔质量是 35.5 g/mol
D . 1 mol N2 的体积是 22.4 L
下列叙述正确的是( )
①标准状况下,0.2mol任何物质的体积均为4.48L
②若1mol气体的体积为22.4L,则它一定处于标准状况下
③标准状况下,1LHCl和1LH2O的物质的量相同
④标准状况下,1gH2和14gN2的体积相同
⑤28gCO的体积为22.4L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A . ①②③④
B . ②③⑥⑦⑧
C . ④⑦⑧
D . ⑤⑥⑦⑧
按要求进行计算,直接写出计算结果:
-
(1) 等质量的NH3和H2S中,氢原子的个数比是。
-
(2) 在相同状况下,等质量的SO2与O2的体积比为,密度比为。
-
(3) 加热13.7 g碳酸钠和碳酸氢钠的固体混合物,使碳酸氢钠完全分解,混合物质量减少了3.1 g,则原混合物中碳酸钠的质量为。
-
(4) 某溶液中只含有Na+、Al3+、Cl-、SO
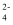 四种离子,已知前三种离子的个数比为3:1:2,则溶液中Al3+和SO
四种离子,已知前三种离子的个数比为3:1:2,则溶液中Al3+和SO 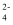 的离子个数比为。
的离子个数比为。
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 含0.4mol HCl的浓盐酸与足量二氧化锰完全反应后,转移的电子数为0.2NA
B . 1L 0.1mol/L NaAlO2溶液中含有的氧原子数大于0.2NA
C . 标准状况下,2.24L稀盐酸中含有0.1NA个HCl分子
D . 1.12L H2中含有氢原子的个数为NA
最近更新



