氧化还原反应的电子转移数目计算 知识点题库
请将下列反应的双线桥写出
-
(1) 8H++2NO3﹣+3Cu=Cu 2++2NO↑+4H2O
-
(2) KClO3+6HCl=KCl+3Cl2↑+3H2O.
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A . 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B . 由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH>-574 kJ/mol
C . 反应①②转移的电子数相同
D . 反应②中当0.2 mol CH4反应完全时转移的电子总数为1.60 mol
-
(1) 在盛有淀粉KI溶液(用H2SO4酸化)的试管中,滴加少量的次氯酸钠溶液,会立即看到溶液变成蓝色,相应的离子方程式为。在盛有淀粉和碘形成的蓝色溶液中,滴加Na2SO3溶液,又发现蓝色溶液逐渐消失,相应的离子方程式为。对比上述两组实验所得结果,可得出ClO-、I2、SO42-的氧化性由强到弱的顺序为 。
-
(2) 氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,产生比它的酸性更强的酸,同时放出气体,该气体混合物经干燥后,平均分子量为47.6,它可以使带火星的木条复燃,并可使润湿的淀粉一碘化钾试纸变蓝。试完成下列各题:
(a)该气体的组成是,气体混合物中各成分的物质的量比为。
(b)写出氯酸分解的化学反应方程式,该反应的氧化产物是(写化学式)。
电解饱和食盐水,当阴极附近有0.8molNaOH生成时,导线中通过电子的物质的量是( )
A . 0.16mol
B . 0.2mol
C . 0.4mol
D . 0.8 mol
某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3 , 杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

-
(1) 固体B的主要用途为(只写一种即可);
-
(2) 第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:、;
-
(3) 第③步中,生成氢氧化铝的离子方程式是。若往A溶液中通入足量CO2 , 产生的沉淀为(填化学式);
-
(4) 工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为(填化学式)。
NA代表阿伏加德罗常数的值,下列叙述正确的是( )
A . 0.1mol 熔融的 NaHSO4 中含有的离子总数为 0.3 NA
B . 标准状况下,2.24L HF和NH3分子所含电子数目均为NA
C . 常温时,56gAl与足量浓硝酸反应,转移的电子数目为3NA
D . 向含有 1mol FeI2 溶质的溶液中通入适量的氯气,当有 1molFe2+被氧化时,该反应转移电子的数目为 3NA
还原沉淀法是处理含铬(含Cr2O  和CrO
和CrO  )工业废水的常用方法,过程如下:
)工业废水的常用方法,过程如下:
 和CrO
和CrO  )工业废水的常用方法,过程如下:
)工业废水的常用方法,过程如下:
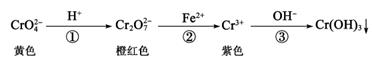
已知:转化过程中的反应为2CrO  (aq) +2H+(aq)
(aq) +2H+(aq)  Cr2O
Cr2O  (aq)+H2O(I)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
(aq)+H2O(I)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
A . 反应①v正(CrO  ) =2v逆(Cr2O
) =2v逆(Cr2O  ) 时,反应处于平衡状态
B . 反应②转移0.6mole- , 则有0.2molCr2O
) 时,反应处于平衡状态
B . 反应②转移0.6mole- , 则有0.2molCr2O  被还原
C . 除去废水中含铬离子的过程包括氧化还原反应和复分解反应
D . 常温下, 要使处理后废水中的c(Cr3+) 降至1×10-5mol·L-1 , 反应③应调溶液pH=5
被还原
C . 除去废水中含铬离子的过程包括氧化还原反应和复分解反应
D . 常温下, 要使处理后废水中的c(Cr3+) 降至1×10-5mol·L-1 , 反应③应调溶液pH=5
 ) =2v逆(Cr2O
) =2v逆(Cr2O  ) 时,反应处于平衡状态
B . 反应②转移0.6mole- , 则有0.2molCr2O
) 时,反应处于平衡状态
B . 反应②转移0.6mole- , 则有0.2molCr2O  被还原
C . 除去废水中含铬离子的过程包括氧化还原反应和复分解反应
D . 常温下, 要使处理后废水中的c(Cr3+) 降至1×10-5mol·L-1 , 反应③应调溶液pH=5
被还原
C . 除去废水中含铬离子的过程包括氧化还原反应和复分解反应
D . 常温下, 要使处理后废水中的c(Cr3+) 降至1×10-5mol·L-1 , 反应③应调溶液pH=5
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 1mol单质Fe与足量的高温水蒸气反应,失去3NA个电子
B . 50mll2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
C . 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA
D . 27g铝中加入1L 1 mol/L  NaOH溶液,转移电子数是3NA
NaOH溶液,转移电子数是3NA
用双线桥标出电子转移的方向和数目,并指出氧化剂和还原剂,氧化产物和还原产物。
Fe2O3+3CO  2Fe+3CO2。
2Fe+3CO2。
氧化剂:;还原剂:;氧化产物:;还原产物:;用双线桥标出电子转移的方向和数目:。
钒元素在酸性溶液中有多种存在形式,其中VO2+为蓝色,VO  为淡黄色,VO
为淡黄色,VO  具有较强的氧化性,浓盐酸能把VO
具有较强的氧化性,浓盐酸能把VO  还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
 为淡黄色,VO
为淡黄色,VO  具有较强的氧化性,浓盐酸能把VO
具有较强的氧化性,浓盐酸能把VO  还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
A . 在酸性溶液中氧化性:VO  >
>  >Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO
>Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO  +4H++2Cl-=2VO2++Cl2↑+2H2O
+4H++2Cl-=2VO2++Cl2↑+2H2O
 >
>  >Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO
>Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO  +4H++2Cl-=2VO2++Cl2↑+2H2O
+4H++2Cl-=2VO2++Cl2↑+2H2O
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 1mol/LFe(NO3)2溶液中,NO  的数目是2NA
B . 反应4FeS2+11O2
的数目是2NA
B . 反应4FeS2+11O2  2Fe2O3+8SO2 , 每生成1molFe2O3转移电子数目22NA
C . 标准状况下,2.24LNO2溶于足量水中充分反应,转移电子数0.1NA
D . 密闭容器中,2molSO2与2molO2充分反应,容器中分子总数为3NA
2Fe2O3+8SO2 , 每生成1molFe2O3转移电子数目22NA
C . 标准状况下,2.24LNO2溶于足量水中充分反应,转移电子数0.1NA
D . 密闭容器中,2molSO2与2molO2充分反应,容器中分子总数为3NA
 的数目是2NA
B . 反应4FeS2+11O2
的数目是2NA
B . 反应4FeS2+11O2  2Fe2O3+8SO2 , 每生成1molFe2O3转移电子数目22NA
C . 标准状况下,2.24LNO2溶于足量水中充分反应,转移电子数0.1NA
D . 密闭容器中,2molSO2与2molO2充分反应,容器中分子总数为3NA
2Fe2O3+8SO2 , 每生成1molFe2O3转移电子数目22NA
C . 标准状况下,2.24LNO2溶于足量水中充分反应,转移电子数0.1NA
D . 密闭容器中,2molSO2与2molO2充分反应,容器中分子总数为3NA
第十三届全国人民代表大会第四次会议政府工作报告指出“要扎实做好碳达峰、碳中和各项工作”,绿色氢能和液态阳光甲醇可助力完成碳中和目标。下列说法正确的是( )
A .  属于电解质
B . 用焦炭与
属于电解质
B . 用焦炭与  反应是未来较好获取氢能的方法
C .
反应是未来较好获取氢能的方法
C .  与
与  反应,每生成1mol
反应,每生成1mol  时转移4mol电子
D . 植树造林、节能减排等有利于实现碳中和
时转移4mol电子
D . 植树造林、节能减排等有利于实现碳中和
 属于电解质
B . 用焦炭与
属于电解质
B . 用焦炭与  反应是未来较好获取氢能的方法
C .
反应是未来较好获取氢能的方法
C .  与
与  反应,每生成1mol
反应,每生成1mol  时转移4mol电子
D . 植树造林、节能减排等有利于实现碳中和
时转移4mol电子
D . 植树造林、节能减排等有利于实现碳中和
NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 12g石墨中含有C-C键的数目为2NA
B . 标准状况下(STP),2.24LCHCl3中含有σ键的数目为0.4NA
C . 常温下,1L0.1mol·L-1HF(Ka=8.1×10-4)溶液中所含H+的数目约为9×10-3NA
D . 5.6gFe发生吸氧腐蚀,最终生成Fe2O3·xH2O,电极之间转移的电子数为0.3NA
下列用单、双线桥表示电子转移的方向和数目错误的是( )
A . 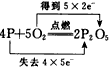 B .
B . 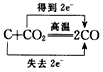 C .
C .  D .
D . 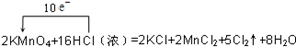
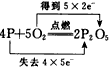 B .
B .  C .
C .  D .
D .
判断下列反应中,电子转移方法错误的是( )
A .  B .
B . 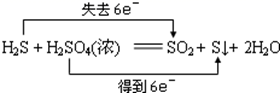 C .
C . 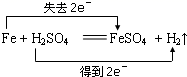 D .
D . 
 B .
B .  C .
C .  D .
D . 
含氰化物的废液乱倒或与酸混合,均易生成有剧毒且易挥发的氰化氢。工业上常采用碱性氯化法来处理高浓度氰化物污水,发生的主要反应为:CN-+OH-+Cl2→CO2+N2+Cl-+H2O(未配平)。下列说法错误的是(其中NA表示阿伏加德罗常数的值)( )
A . Cl2是氧化剂,CO2和N2是氧化产物
B . 上述离子方程式配平后,氧化剂、还原剂的化学计量数之比为2:5
C . 该反应中,若有1molCN-发生反应,则有5NA电子发生转移
D . 若将该反应设计成原电池,则CN-在负极区发生反应
二氧化氯(ClO2)是国际上公认的安全、无毒、绿色消毒剂和去污剂,可用于饮用水和环境的消毒杀菌处理,可以除去水体或环境中的氰化物污染等,除去氰化物污染的反应原理2ClO2+2CN-=2CO2+N2+2Cl-。下列关于该反应的说法错误的是( )
A . 氧化剂只有ClO2
B . 氧化剂与还原剂的物质的量之比为1:1
C . 氧化产物只有CO2
D . 转移1 mol电子时,理论上生成6.72L(标准状况)气体
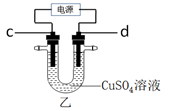
如图,甲是氢氧燃料电池示意图,a为正极;乙是惰性电极电解足量CuSO4溶液的示意图,电解时c电极上有红色固体物质析出。
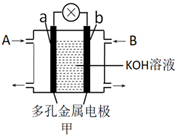
回答下列问题:
-
(1) 图甲中,从A口通入的气体是,b电极的电极反应式为。
-
(2) 图乙中,c电极通过导线与电源的极相连;理论上当c电极析出3.20g红色固体时,则d电极表面产生的气体在标准状况下的体积为mL。
纳米铁(直径一般从几纳米到几十纳米)可通过不同反应机制(吸附、还原、催化氧化)去除环境有机、无机污染物,通过番石榴叶提取液还原Fe3+制备纳米铁(Fe0)氧化去除As(Ⅲ)(罗马数字为元素的化合价)的过程如图所示。下列叙述不正确的是( )
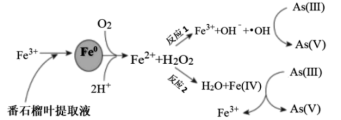
A . 将纳米铁与水形成分散系,可以发生丁达尔效应
B . 反应1的前半程,1 mol H2O2反应转移2 mol电子
C . 反应2中,Fe2+与H2O2的物质的量之比为1:1
D . 若要氧化去除1 mol As(Ⅲ),则至少需要112 g纳米铁
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A . 标准状况下,22.4L CO2中共用电子对数目为2 NA
B . 标准状况下,46g NO2与N2O4的混合物中所含的原子总数目为3NA
C . 100g质量分数为49%的硫酸溶液,含有的氧原子数目为2NA
D . 一定条件下 ,0.2mol SO2与0.1mol O2充分反应后转移电子总数为0.4 NA
最近更新



