氧化还原反应的电子转移数目计算 知识点题库
-
(1) 某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30% H2O2、0.1mol•L﹣1 Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:
②设计实验方案:在不同H2O2浓度下,测定(要求所测得的数据能直接体现反应速率大小).
③设计实验装置,完成如1图所示的装置示意图.

④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
实验序号
物理量
V[0.1mol•L﹣1 Fe2(SO4)3]/mL
1
a
2
a
-
(2) 利用图2(a)和2(b)中的信息,按图2(c)装置(连能的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),其原因是.
2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
关于该反应说法正确的是( )
 恰好能氧化5个
恰好能氧化5个  ,则还原产物中变价元素的化合价是( )
,则还原产物中变价元素的化合价是( )
 的值不变
C . 反应NH4Cl+NaNO2=NaCl+N2↑+2H2O,每生成1molN2转移电子数为6×6.02×1023
D . 常温下,Ksp[Mg(OH)2]=1.8x10-11 , Kb(NH3·H2O)=1.8x10-5 , NH4Cl饱和溶液中加入少量Mg(OH)2 , 振荡,固体逐渐溶解
的值不变
C . 反应NH4Cl+NaNO2=NaCl+N2↑+2H2O,每生成1molN2转移电子数为6×6.02×1023
D . 常温下,Ksp[Mg(OH)2]=1.8x10-11 , Kb(NH3·H2O)=1.8x10-5 , NH4Cl饱和溶液中加入少量Mg(OH)2 , 振荡,固体逐渐溶解
-
(1) 研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。
已知:①CH3OH(g) + 3/2 O2(g) = CO2(g) + 2H2O(l) ∆H1= a kJ/mol②H2(g) + 1/2 O2(g) = H2O(l) ∆H2= b kJ/mol ③H2O(g) = H2O(l) ∆H3= c kJ/mol,则CO2和H2反应生成CH3OH和水蒸气的热化学方程式为。
-
(2) 用Cu2Al2O4作催化剂制备乙酸。已知:CO2(g)+CH4(g)
 CH3COOH(g) ∆H2=akJ/mol。
CH3COOH(g) ∆H2=akJ/mol。 ①各物质相对能量大小如图所示,则a=。

②该反应的速率方程可表示为:v(正)=k正c(CO2)c(CH4)和v(逆)=k逆c(CH3COOH),k正和k逆在一定温度时为常数,分别称作正,逆反应速率常数,请写出用k正 , k逆表示的平衡常数的表达式K=。
-
(3) 将CO2和CH4在一定条件下反应可制得工业合成气,在1 L 密闭容器中通入CH4与CO2 , 使其物质的量浓度为1.0 mol/L,在一定条件下发生反应:CH4(g) + CO2(g) ⇌ 2CO(g) + 2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图所示:

则:
①压强p1 , P2 , P3 , P4由大到小的关系为。
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),如果P4=2 MPa,求x点的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施中能使平衡体系中c(CO)/c(CO2)减小的是 。
A.升高温度 B.增大压强
C.保持温度、压强不变,充入He D.恒温、恒容,再充入1 mol CO2和1 mol CH4
-
(4) 科学家还研究了其他转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,N极的电极反应式为,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为mol,N极电解质溶液∆m=g。

-
(1) I.一定条件下,在5L密闭容器中充入1 mol CO2和3 mol H2 , 发生反应:xCO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。 x=;0~3min内H2的平均反应速率v(H2)=mol/(L·min)。
-
(2) 下列措施能提高正反应速率的是 (填正确答案的字母)。
A 降低温度 B 增加CO2的量 C 使用催化剂 D 及时分离出甲醇

-
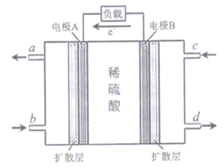
(3) II.甲醇燃料电池可使甲醇作燃料时的能量转化更高效,某种甲醇然料电池的工作原理如图所示,其电极反应如下:2CH3OH+2H2O-12e- =12H+ 2CO2 3O2+12H++12e-=6H2O
该装置的负极是电极 (填“A”或“B”);c处通入的物质是 (填“CH3OH”或“O2”)。
-
(4) 甲醇燃料电池供电时的总反应方程式为
-
(5) 当该装置消耗0.2 mol甲醇时,转移电子的数目为;若这部分电子全部用于电解水,理论上可产生氢气L(标准状况)
 N2+2H2O,关于该反应的说法错误的是( )
N2+2H2O,关于该反应的说法错误的是( )

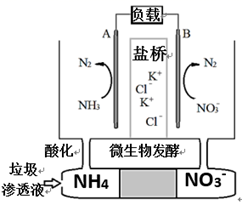
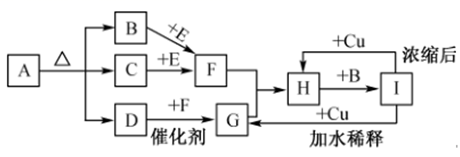
-
(1) 写出下列各物质的化学式:H、I。
-
(2) 请写出下列反应的化学方程式:
①C→F
②A受热分解:
-
(3) 请写出I→G的离子方程式:,当有2mol的G生成时反应转移的电子数为。



