化学方程式的有关计算 知识点题库
-
(1) a= (保留2位小数).
-
(2)
WOa中存在五价和六价两种价态的钨.则蓝色钨的氧化物中这两种价态的钨原子数之比为
将铁锰的钨酸盐[(Fe,Mn)WO4]碱熔,发生如下反应(设空气中N2、O2的体积分数分别为0,.8和0.2):
4FeWO4+4Na2CO3+O2
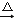 4Na2WO4+2Fe2O3+4CO2 ①
4Na2WO4+2Fe2O3+4CO2 ①2MnWO4+2Na2CO3+O2
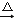 2Na2WO4+2MnO2+2CO2②
2Na2WO4+2MnO2+2CO2② -
(3) 根据反应①,若反应前空气为100L,反应后气体为160L(气体体积在同温同压下测定),则反应后所得气体中CO2的体积分数为
-
(4) 某工厂投料550mol Na2CO3制备Na2WO4 , 每反应1mol O2时,气体就增加1.5mol,则生成物中Fe2O3与MnO2的物质的量之比为 ;若反应后气体增加300mol,制得Na2WO4 mol.
-
(5) 由Na2WO4制备W的第一步反应为:Na2WO4+2HCl→H2WO4↓+2NaCl.往1L密度为1,.190g/cm3的37%的浓盐酸加入6.030mol Na2WO4 , 恰好完全反应.将产生的沉淀过滤后,溶液中溶质只有NaCl,求该溶液中NaCl的质量分数(25℃时NaCl的溶解度为36.0g/100g水)
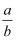 的值可能为( )
的值可能为( )
-
(1) 焦硫酸(H2SO4 . SO3)溶于水,其中的SO3都转化为硫酸.若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 mol/L.
-
(2) 若以浓硫酸吸水后生成H2SO4 . H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
-
(3) 硫铁矿是工业上制硫酸的主要原料.硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2 4FeS2+11O2→2Fe2O3+8SO2
若48molFeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比.
-
(4) 用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法.
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体).
已知空气组成:N2体积分数0.79、O2体积分数0.21.
①2:7 ②5:4 ③4:5 ④7:2.

-
(1) 生成氢气的物质的量;
-
(2) 这些氢气在标准状况下的体积.
 MnCl2+Cl2↑+2H2O收集到7.1g氯气,求:
MnCl2+Cl2↑+2H2O收集到7.1g氯气,求:
-
(1) 发生反应的二氧化锰的物质的量是多少?
-
(2) 被氧化的氯化氢的物质的量是多少?
-
(1) 下列实验事实或实验现象,反映了硫酸的哪些性质.
①在工业上可用铁制槽车或铝制槽车运输浓硫酸.
②浓硫酸加入蔗糖中搅拌得到黑色固体.
③实验室用锌粒和稀H2SO4反应制备氢气.
④Cu与浓硫酸反应后在试管底部析出有灰白色固体.
-
(2) 有①
 O、
O、 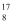 O、
O、  O ②H2、D2、T2③S8、S4、S2④
O ②H2、D2、T2③S8、S4、S2④  H、
H、 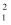 H、
H、  H四组微粒或物质.互为同位素的是(填序号);互为同素异形体的是(填序号);由①和④的微粒可组成种不同的三原子化合物.
H四组微粒或物质.互为同位素的是(填序号);互为同素异形体的是(填序号);由①和④的微粒可组成种不同的三原子化合物.
-
(3) 将aml NO、bml NO2和xml O2混和于同一试管,将试管口倒插入水中.要使反应后试管内的气体全部消失,则x与a、b之间应满足的关系式是a+b=.
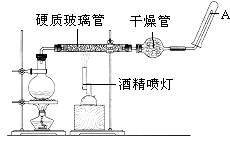
请回答下列的问题.
-
(1) 铁在周期表中的位置是.
-
(2) 请写出该反应的化学方程式:.
-
(3) 曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为.
-
(4) 现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含b mol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO.试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
①
②
③
④
溶液中的金属离子
Fe2+
残留固体成分
Fe、Pt
Pt
Pt
②当x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mL NO.则a=,b=.
-
(1) 求生成沉淀物的质量;
-
(2) 反应中消耗氯化钡的物质的量;
-
(3) 反应后溶液的物质的量浓度.
-
(1) I.氨和硝酸都是重要的工业原料,标准状况下,将640L氨气溶于水形成1L氨水,则此氨水的物质的量浓度为mol/L(保留三位有效数字).将体积为12mL的试管充满NO2气体后,倒立于水槽中(保持同温同压),液面稳定后,保持相同条件下再通入O2 , 若要液面仍在原来的位置,则通入O2的体积为mL。
-
(2) 工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH- =NO2-+NO3-+H2O和NO+NO2+2OH- =+H2O(配平该方程式)。
-
(3) Ⅱ.在标准状况下,分别取30mL相同浓度的盐酸依次装入①②③试管中,然后分别慢慢加入组成相同的镁铝混合物,相同条件下,测得有关数据如表所示(反应前后溶液体积不发生变化)。
实验序号
①
②
③
混合物质量/mg
255
510
1020
气体体积/mL
280
336
336
①组实验中,盐酸,(填过量或不足);②组实验中,盐酸,(填过量或不足)。
盐酸的物质的量浓度为mol/L。
混合物中Mg和Al的物质的量之比为。
 、
、 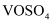 和不溶性硅酸盐)制备
和不溶性硅酸盐)制备  的新工艺流程如图:
的新工艺流程如图: 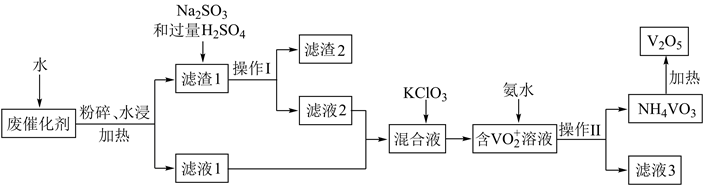
已知:滤液1和滤液2中钒以  的形式存在。回答下列问题:
的形式存在。回答下列问题:
-
(1) 在实验室中操作Ⅰ用到的玻璃仪器有。
-
(2) 在滤渣1中加入
 和过量
和过量  溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为。
溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为。
-
(3) 混合溶液中加入
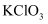 ,发生反应的离子方程式是。
,发生反应的离子方程式是。
-
(4) 钒最后以
 的形式沉淀出来。沉钒率(
的形式沉淀出来。沉钒率(  沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是(写一条即可)。
沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是(写一条即可)。 
-
(5) 称取w g所得产品,先用硫酸溶解,得到
 溶液,再加入
溶液,再加入  的
的  溶液,最后用
溶液,最后用  酸性
酸性  溶液滴定过量的
溶液滴定过量的  至终点,消耗溶液
至终点,消耗溶液  的体积为
的体积为  。假设杂质不参与反应,锰被还原为
。假设杂质不参与反应,锰被还原为  。则产品中
。则产品中  的质量分数为,(已知
的质量分数为,(已知  和
和  溶液反应的离子方程式为
溶液反应的离子方程式为 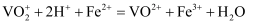 )
)
 时,将13 g锌铁合金完全溶于100 mL
时,将13 g锌铁合金完全溶于100 mL 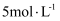 盐酸中。假设反应前后溶液的体积不发生变化,下列说法错误的是( )
盐酸中。假设反应前后溶液的体积不发生变化,下列说法错误的是( )
 浓度为
浓度为 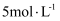 C . 可用碱石灰除去
C . 可用碱石灰除去  中混有的
中混有的  和水蒸气
D . 向所得溶液中加入过量
和水蒸气
D . 向所得溶液中加入过量  溶液最终会观察到有红褐色沉淀生成
溶液最终会观察到有红褐色沉淀生成



