化学方程式的有关计算 知识点题库
用1L1mol•L﹣1NaOH溶液吸收0.6molCO2 , 所得溶液中Na2CO3和NaHCO3的物质的量之比约为( )
A . 2:3
B . 1:2
C . 2:1
D . 3:2
实验室里常用浓盐酸跟高锰酸钾反应来制取少量氯气,反应的化学方程式为:
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.
-
(1) 将上述方程式改写为离子方程式:.
-
(2) 反应中体现了浓盐酸的、.(填性质)
-
(3) 若反应中产生了的Cl2气体的体积 (标准状况下)为4.48L,则该反应中转移电子的物质的量是 mol,作氧化剂的浓盐酸是mol.
次磷酸H3PO2是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物A.经鉴定:反应后的溶液是磷酸和硫酸的混合物;X射线衍射证实A中各元素的原子个数相等;A的主要化学性质如下:
①温度超过60℃,分解成金属铜和一种气体;
②在氯气中着火;
③与盐酸反应放出气体.
-
(1) A的化学式为
-
(2) A的生成反应方程式为.
将铁与氧化铁的混合物15克,加入150mL稀硫酸中,标况下放出氢气1.68升,同时铁和氧化铁均无剩余,向溶液中滴加KSCN溶液,未见颜色变化.
-
(1) 混合物中铁的质量为 g.
-
(2) 为使Fe2完全转化为Fe(OH)2 , 共消耗3mol•L﹣1的氢氧化钠溶液200mL,则原硫酸的物质的量浓度为.
将6.4g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余.试计算:提示:(Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O)
CuSO4+SO2↑+2H2O)
 CuSO4+SO2↑+2H2O)
CuSO4+SO2↑+2H2O)-
(1) 参加反应的硫酸的物质的量.
-
(2) 生成的SO2的体积(标准状况下).
-
(3) 将反应后的溶液用水稀释到100mL,计算硫酸铜溶液的物质的量浓度.
50ml浓H2SO4溶液(足量)中加入3.2g Cu,在加热条件下充分反应:
-
(1) 反应消耗的H2SO4的物质的量是,生成SO2的体积为(标准状况下) mL.
-
(2) 若题干中浓硫酸的物质的量浓度为a mol•L﹣1 , 投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4) 0.025a mol(填“等于”、“大于”或“小于”).
-
(3) 将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,求原浓硫酸的物质的量浓度.
M(NO3)2热分解化学方程式为:2M(NO3)2 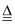 2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是( )
2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是( )
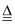 2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是( )
2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是( )
A . 148g/mol
B . 24g/mol
C . 74g/mol
D . 40g/mol
4.6g纯净金属钠在干燥空气中被氧化后,得到7.0g固体,由此可判断其氧化产物是( )
A . 只有Na2O
B . 只有Na2O2
C . Na2O2和Na2O
D . 无法确定
填写下列空白:
-
(1) 某元素的气态氢化物的化学式XH4 , 则其最高价氧化物对应的水化物的化学式为.
-
(2) 氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则氧元素的相对原子质量为.
-
(3) 物质的量相同的H2O和D2O与足量钠反应,放出的气体的质量之比为.
-
(4) X2﹣含中子N个,X的质量数为A,则1g X的氢化物中含质子的物质的量是mol.
-
(5) 铷和另一种碱金属形成的合金4.6g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是:.
用20 mL 18.4 mol/L的浓H2SO4与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液加水稀释到100 mL,所得溶液中SO2的浓度为3.18 mol/L,则此时溶液中CuSO4的物质的量浓度为( )
A . 0.50 mol/L
B . 0.75 mol/L
C . 1.00 mol/L
D . 3.18 mol/L
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合溶液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
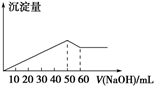
A . 6∶1
B . 3∶1
C . 2∶1
D . 1∶2
等体积、等物质的量浓度的稀硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积之比为5∶6,则甲、乙两烧杯中的反应情况是( )
A . 甲、乙中都是铝过量
B . 甲中铝过量、乙中碱过量
C . 甲中酸过量、乙中铝过量
D . 甲中酸过量、乙中碱过量
0.1 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
A . 第三周期第IA族
B . 第四周期第IA族
C . 第三周期第ⅡA族
D . 第四周期第ⅡA族
相同质量的铝分别投入足量的下列物质中反应生成氢气,消耗溶质物质的量最少的是( )
A . 稀硫酸
B . 稀盐酸
C . 氢氧化钡溶液
D . 氢氧化钠溶液
一定量的甲烷恰好与一定量的氧气完全反应后得到CO、CO2和水蒸气共30.4g,该产物缓缓通过浓硫酸充分吸收后,浓硫酸增重14.4g,则此甲烷完全燃烧还需要氧气的体积(标准状况)为( )
A . 1.12L
B . 2.24L
C . 3.36L
D . 4.48L
短周期主族元素X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,Y 原子最外层电子数等于内层电子数的2 倍,Q 的单质与稀硫酸反应生成X的单质。向100mLX2R 的水溶液中缓缓通入RZ2气体,溶液 pH 与 RZ2体积关系如下图。下列说法错误的是( )
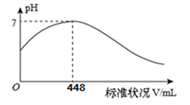
A . X2R溶液的浓度为0.4mol/L
B . X简单阴离子半径大于锂离子半径
C . 工业上采用电解熔融Q的氧化物的方法冶炼Q 的单质
D . RZ3 通入BaCl2、Ba(NO3)2溶液中,均产生相同的白色沉淀物质
向溶10mLNaHSO4液中逐滴滴加Ba(OH)2溶液,产生沉淀的质量m与加入的Ba(OH)2的物质的量n之间的关系如图所示,下列说法错误的是( )
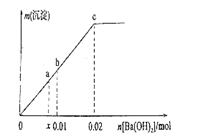
A . a点溶液中离子浓度:c(Na+)>c(SO  )
B . b点溶液为中性,c点SO
)
B . b点溶液为中性,c点SO  恰好沉淀完全
C . b→c段发生反应为H++SO
恰好沉淀完全
C . b→c段发生反应为H++SO  +Ba2++OH-=BaSO4↓+H2O
D . 原溶液的浓度为2.0mol•L-1
+Ba2++OH-=BaSO4↓+H2O
D . 原溶液的浓度为2.0mol•L-1
 )
B . b点溶液为中性,c点SO
)
B . b点溶液为中性,c点SO  恰好沉淀完全
C . b→c段发生反应为H++SO
恰好沉淀完全
C . b→c段发生反应为H++SO  +Ba2++OH-=BaSO4↓+H2O
D . 原溶液的浓度为2.0mol•L-1
+Ba2++OH-=BaSO4↓+H2O
D . 原溶液的浓度为2.0mol•L-1
在标准状况下,将6.5g锌和4.6g钠分别与2.24L氯化氢溶于水形成的盐酸溶液反应,则放出H2的体积( )
A . 锌和钠放出一样多
B . 锌的多
C . 钠的多
D . 无法比较
实验室制备氧气也常用加热分解 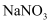 制得,发生反应:
制得,发生反应:  ;取8.5g硝酸钠固体置于装置,加热一段时间,收集到VmL氧气后,停止加热,待固体冷却后称得剩余7.22g,将剩余固体溶于水配制成100mL稀溶液,加入足量铜片,并滴入稀硫酸,使其充分反应(气体只有NO)(已知:
;取8.5g硝酸钠固体置于装置,加热一段时间,收集到VmL氧气后,停止加热,待固体冷却后称得剩余7.22g,将剩余固体溶于水配制成100mL稀溶液,加入足量铜片,并滴入稀硫酸,使其充分反应(气体只有NO)(已知: 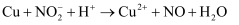 ,未配平),求:
,未配平),求:
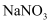 制得,发生反应:
制得,发生反应:  ;取8.5g硝酸钠固体置于装置,加热一段时间,收集到VmL氧气后,停止加热,待固体冷却后称得剩余7.22g,将剩余固体溶于水配制成100mL稀溶液,加入足量铜片,并滴入稀硫酸,使其充分反应(气体只有NO)(已知:
;取8.5g硝酸钠固体置于装置,加热一段时间,收集到VmL氧气后,停止加热,待固体冷却后称得剩余7.22g,将剩余固体溶于水配制成100mL稀溶液,加入足量铜片,并滴入稀硫酸,使其充分反应(气体只有NO)(已知: 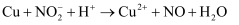 ,未配平),求:
,未配平),求:
-
(1) V=;
-
(2) 溶解铜的质量是:g(写出简单计算过程)
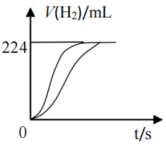
量取8.0 mL 5.0 mol/L H2SO4溶液,加蒸馏水稀释至100 mL,取两份稀释后的H2SO4溶液各25 mL,分别加入等质量的Al和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。
请计算:
-
(1) 稀释后H2SO4溶液的物质的量浓度为。
-
(2) 加入Fe的质量至少有g。
最近更新



