分子间作用力 知识点题库
当水的温度和压强升高到临界点(t=374.3℃,p=22.05MPa)以上时,水就处于超临界状态,该状态的水即称之为超临界水.超临界水具有通常状态下水所没有的特殊性质,它可以和空气、氧气及一些有机物质均匀混合.如果超临界水中同时溶有氧气和有机物,则有机物可迅速被氧化为二氧化碳、氮气、水等小分子化合物.有关超临界水的叙述错误的是( )
A . 超临界水可处理有机废物
B . 超临界水是一种新物质
C . 超临界水是水的一种状态
D . 超临界水氧化技术不形成二次污染
下列变化过程中,克服的是分子间作用力的是( )
A . 烧碱溶于水
B . 氯化氢气体溶于水
C . 二氧化碳变成干冰
D . 加热碘化氢使其分解
微粒间相互作用的能量:范德华力为a kJ•mol﹣1 , 化学键为b kJ•mol﹣1 , 氢键为c kJ•mol﹣1 , 则一般情况下a、b、c的大小关系正确的是( )
A . a>b>c
B . b>a>c
C . c>b>a
D . b>c>a
实现下列变化时,需克服相同类型作用力的是( )
A . 水晶和干冰的熔化
B . 食盐和冰醋酸熔化
C . 氯化铵和水的分解
D . 纯碱和烧碱的熔化
下列有关范德华力的叙述正确的是( )
A . 范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B . 范德华力与化学键的区别是作用力的强弱不同
C . 任何分子间在任意情况下都会产生范德华力
D . 范德华力非常微弱,故破坏范德华力不需要消耗能量
下列变化中,不需要破坏化学键的是( )
A . 加热氯化铵
B . 碘升华
C . 食盐溶于水
D . 氯化氢溶于水
一般情况下,前者无法决定后者的是( )
A . 分子间作用力的大小——分子的稳定性
B . 原子的质子数——元素的种类
C . 原子核外电子排布——主族元素在周期表中的位置
D . 物质内部储存的能量——化学反应的热效应
一般情况下,前者无法决定后者的是( )
A . 原子核外电子排布——元素在周期表中的位置
B . 分子间作用力的大小——分子稳定性的高低
C . 弱电解质的相对强弱——电离常数的大小
D . 物质内部储存的能量——化学反应的热效应
下列说法正确的是( )
A . 静电除尘器除去空气或工厂废气中的飘尘利用的是胶体的丁达尔效应
B . 0.1mol/L的醋酸和盐酸分别稀释10倍,溶液的pH前者小于后者
C .  溶于水和干冰升华都只有分子间作用力改变
D . 若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
溶于水和干冰升华都只有分子间作用力改变
D . 若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
 溶于水和干冰升华都只有分子间作用力改变
D . 若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
溶于水和干冰升华都只有分子间作用力改变
D . 若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
下列说法正确的是( )
A . H+和S2-的最外电子层都形成了8个电子的稳定结构
B . C60和金刚石都是原子间通过共价键结合形成的原子晶体
C . Na和H2O混合时放出热量与微粒之间的作用力有关
D . H2O2易分解是因为H2O2分子间作用力弱
下列说法中正确的是( )
①离子化合物中一定有离子键,可能有共价键
②NaHSO4固体中阳离子和阴离子的个数比是1:1
③非金属单质中不含离子键,一定只含共价键
④稳定性:H2O>H2S,沸点:H2O<H2S
⑤NaCl和HCl溶于水破坏相同的作用力
⑥非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A . ①②⑥
B . ①③④⑥
C . ①⑥
D . ①④⑤
下列物质的性质与分子间作用力无关的是( )
A . 等质量的冰比液态水的体积大
B . 沸点:H2O>H2Te>H2Se>H2S
C . 稳定性:HF>HCl>HBr>HI
D . NH3比PH3易液化
下列粒子性质递变趋势正确的是( )
A .  B .
B . 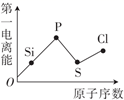 C .
C . 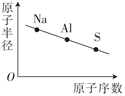 D .
D . 
 B .
B .  C .
C .  D .
D . 
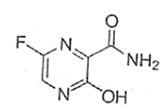
完成下列问题:法匹拉韦是治疗新冠肺炎的一种药物,结构简式如图。
-
(1) 该药物分子中,电负性最大的元素是。
-
(2) 该分子的所有原子(填“是”或“否”)共平面。
-
(3) 分子中氧原子参与形成键(填“极性”或“非极性”)
-
(4) C、N、O、F四种元素的简单氢化物中沸点最低的是(填化学式)。
下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
A . 液溴和碘分别受热变为气体
B . 干冰和氯化铵分别受热变为气体
C . 二氧化硅和氧化钠分别受热熔化
D . 食盐和氯化氢分别溶解在水中
下列说法正确的是( )
A . 在由分子所构成的物质中,分子间作用力越大,该物质越稳定
B . 冰融化时,水分子中H-O键发生断裂
C . 离子的还原性:  D . 沸点:
D . 沸点: 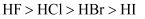
 D . 沸点:
D . 沸点: 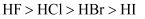
下列说法正确的是( )
A . 石英、金刚石、冰都是通过共价键形成的原子晶体
B . 干冰气化时吸收的热量用于克服分子内碳、氧原子间的作用力
C . 氯化氢和氯化钠溶于水都能电离出  ,所以氯化氢和氯化钠均是离子化合物
D .
,所以氯化氢和氯化钠均是离子化合物
D .  和
和  分子中氧原子的最外电子层都具有8电子的稳定结构
分子中氧原子的最外电子层都具有8电子的稳定结构
 ,所以氯化氢和氯化钠均是离子化合物
D .
,所以氯化氢和氯化钠均是离子化合物
D .  和
和  分子中氧原子的最外电子层都具有8电子的稳定结构
分子中氧原子的最外电子层都具有8电子的稳定结构
有关物质结构的下列说法中正确的是( )
A . 碘升华时破坏了共价键
B . 氯化钠固体中的离子键在溶于水时被破坏
C . 含极性键共价化合物一定是电解质
D . HF分子间作用力大于HCl,故HF比HCl稳定
类石墨相氮化碳(g—C3N4)作为一种新型光催化材料,在光解水产氢等领域具有广阔的应用前景,研究表明,非金属掺杂(O、S等)能提高其光催化活性。g—C3N4 , 具有和石墨相似的层状结构,其中一种二维平面结构如图所示。下列关于g—C3N4 , 的说法错误的是( )

A . 基态C原子的成对电子数与未成对电子数之比为2:1
B . N、O、S的第一电离能(I1)大小为I1(N)>I1(O)>I1(S)
C . g—C3N4晶体中存在的微粒间作用力有非极性键、π键和范德华力
D . g—C3N4中,C原子的杂化轨道类型为sp2杂化,N原子的配位数为2和3
回答下列问题:
-
(1) 已知:
CH4
SiH4
NH3
PH3
沸点/K
101.7
161.2
239.7
185.4
分解温度/K
873
773
1073
713.2
分析表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的各自原因是。
②结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时(填化学式)先液化。
-
(2) SO2与CO2分子的空间结构分别是和,相同条件下两者在水中的溶解度较大的是(填化学式),理由是。
-
(3) 肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在(填字母)。
a.离子键 b.共价键 c.配位键 d.范德华力
-
(4) 有机物
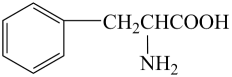 中含有个手性碳原子。
中含有个手性碳原子。
-
(5) “金山银山不如绿水青山”,汽车尾气治理是我国一项重要的任务。经过化学工作者的努力,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:N2(g)+O2(g)
 2NO(g) ΔH=+180.5kJ·mol-1
2NO(g) ΔH=+180.5kJ·mol-1若1mol N2(g)、1mol O2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1mol NO(g)分子中化学键断裂时需吸收的能量为kJ。
最近更新



