分子间作用力 知识点
分子间作用力 知识点题库
A组 | B组 |
Ⅰ.H—I键的键能大于H—Cl键的键能 | ①HI比HCl稳定 |
Ⅱ.H—I键的键能小于H—Cl键的键能 | ②HCl比HI稳定 |
Ⅲ.H2S的范德华力大于H2O的范德华力 | ③H2S的沸点比H2O的高 |
Ⅳ.HI的范德华力小于HCl的范德华力 | ④HI的沸点比HCl的低 |

下列关于水的说法正确的是( )
①H2 ②O2 ③P4(白磷) ④SO2 ⑤CO2
⑥H2O2 ⑦HF ⑧H2N—CH2CH2COOH
⑨C2H6
①分子晶体中都存在共价键; ②在晶体中只要有阳离子就一定有阴离子;
③金刚石、NaF、NaCl、H2O、H2S晶体的熔点依次降低;
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键;
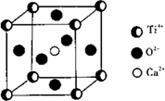
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti3+和12个O2-相邻;
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合;
⑦晶体中分子间作用力越大,分子越稳定;
⑧氯化钠熔化是离子键被破坏
-
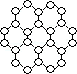
(1) 下列有关石墨烯说法正确的是________________。A . 键长:石墨烯>金刚石 B . 石墨烯分子中所有原子可以处于同一平面 C . 12g石墨烯含
 键数为NA
D . 从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
键数为NA
D . 从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
-
(2) 化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①铜原子在基态时,在有电子填充的能级中,能量最高的能级符号为;第四周期元素中,最外层电子数与铜相同的元素还有。
②乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因。
③下列分子属于非极性分子的是。
a.甲烷 b.二氯甲烷 c.苯 d.乙醇
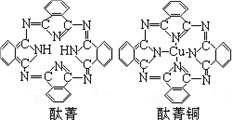
④酞菁与酞菁铜染料分子结构如图,酞菁分子中碳原子采用的杂化方式是;酞菁铜分子中心原子的配位数为。
⑤金与铜可形成的金属互化物合金(如图,该晶胞中,Au占据立方体的8个顶点):
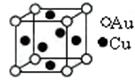
它的化学式可表示为;在Au周围最近并距离相等的Cu有个,若2个Cu原子核的最小距离为d pm,该晶体的密度可以表示为g/cm3。(阿伏加德罗常数用NA表示)
①离子化合物中一定含有离子键;②含有共价键的化合物一定是共价化合物;③非金属单质分子中一定含有非极性共价键;④分子间作用力比化学键弱得多;⑤含有离子键的化合物中一定含有金属元素;⑥氢键不是化学键;⑦不同元素组成的多原子分子中的化学键一定都是极性键
分析上图可知:
-
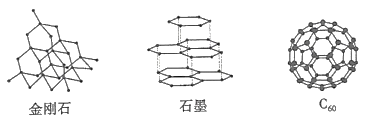
(1) 金刚石的晶体类型是,晶体中每个最小环上的碳原子的个数是。
-
(2) 石墨晶体呈层状结构,层内每个正六边形拥有的碳原子的个数是,层与层之间的作用力是。
-
(3) C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则Co分子中σ键与π键数目之比为。
-
(1) 由以上元素组成的分子:DE2、DA4、AJ中,属于极性分子的是。(填真实化学式)。
-
(2) A2E和DJ4是两种常见溶剂,真实化学式分别为 和,D2A4在前者中的溶解度(填“大于”或“小于”)在后者中的溶解度。
-
(3) GA4的沸点(填“高于”或“低于”)DA4的沸点,GE2的熔点(填“高于”或“低于”)DE2的熔点。
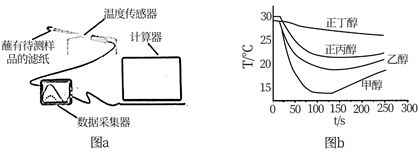
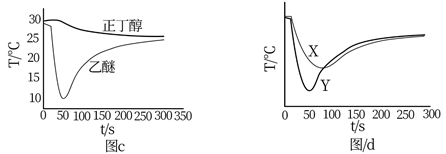
 CH3CH2CH3 , 回答下列问题:
CH3CH2CH3 , 回答下列问题:
-
(1) 基态Rh原子的价电子排布式为4d85s1 , 铑在周期表的位置是,其原子中的未成对电子数为。
-
(2) 1mol丙烯(CH3CH=CH2)中σ键的数目为,其结构简式中打点的C原子与H原子间的σ键可称为sp2-sσ键,则丙烯分子中C原子之间的所有σ键可称为。
-
(3) 第一电离能PCl(填“大于”或“小于”),PPh3是
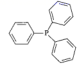 的缩写,该分子的立体构型是。比较PPh3与PH3的沸点大小,并说明原因。
的缩写,该分子的立体构型是。比较PPh3与PH3的沸点大小,并说明原因。
-
(4) RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):
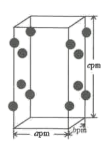
①晶胞中含有的Cl-数目为;
②若阿伏加德罗常数为NA , 则晶体的密度为g·cm-3.(列出计算式)
 )的结构或结构单元分别如图1、图2、图3所示。
)的结构或结构单元分别如图1、图2、图3所示。
回答下列问题:
-
(1) 图1为某晶体硼的部分结构单元,该结构单元由20个等边三角形构成,则构成此结构单元的B原子数为,图中标记1、2、3的3个B原子形成的夹角为。
-
(2) 已知 H3BO3与NaOH溶液反应时,当NaOH过量时,发生反应的化学方程式为
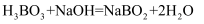 , 当H3BO3过量时,发生反应的化学方程式为
, 当H3BO3过量时,发生反应的化学方程式为 , 则H3BO3是元弱酸,硼酸晶体中存在的作用力有(填标号)。
, 则H3BO3是元弱酸,硼酸晶体中存在的作用力有(填标号)。a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
-
(3)
 中得电子的原子是(填元素符号),结构中B原子的杂化方式为。
中得电子的原子是(填元素符号),结构中B原子的杂化方式为。
 NH
NH +OH-可知NH3•H2O的合理结构式为
+OH-可知NH3•H2O的合理结构式为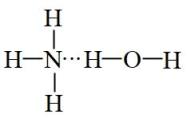 D . 形成配位键的金属离子通常是过渡金属离子,许多金属配合物有鲜艳的颜色
D . 形成配位键的金属离子通常是过渡金属离子,许多金属配合物有鲜艳的颜色



