зӣ–ж–Ҝе®ҡеҫӢеҸҠе…¶еә”з”Ё зҹҘиҜҶзӮ№йўҳеә“

пјҲ1пјү101KPaж—¶пјҢ1molж°”жҖҒCH3OHе®Ңе…ЁзҮғзғ§з”ҹжҲҗCO2ж°”дҪ“е’Ңж¶ІжҖҒж°ҙж—¶пјҢж”ҫеҮә726.51kJзҡ„зғӯйҮҸпјҢеҲҷз”ІйҶҮзҮғзғ§зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸжҳҜ пјҺ
пјҲ2пјүз”ІйҶҮиҙЁеӯҗдәӨжҚўиҶңзҮғж–ҷз”өжұ дёӯе°Ҷз”ІйҶҮи’ёжұҪиҪ¬еҢ–дёәж°ўж°”зҡ„дёӨз§ҚеҸҚеә”еҺҹзҗҶжҳҜпјҡ
в‘ CH3OHпјҲgпјү+H2O пјҲgпјүв•җCO2пјҲgпјү+3H2пјҲgпјүпјӣв–іH1в•җ+49.0KJвҖўmolп№Ј1
в‘ЎCH3OHпјҲgпјү+ O2 пјҲgпјүв•җCO2пјҲgпјү+2H2пјҲgпјүпјӣв–іH2в•җпјҹ
O2 пјҲgпјүв•җCO2пјҲgпјү+2H2пјҲgпјүпјӣв–іH2в•җпјҹ
е·ІзҹҘH2пјҲgпјү+ O2 пјҲgпјүв•җH2O пјҲgпјүв–іHв•җп№Ј241.8KJвҖўmolп№Ј1 пјҢ еҲҷеҸҚеә”в‘Ўзҡ„в–іH2= пјҺ
O2 пјҲgпјүв•җH2O пјҲgпјүв–іHв•җп№Ј241.8KJвҖўmolп№Ј1 пјҢ еҲҷеҸҚеә”в‘Ўзҡ„в–іH2= пјҺ
пјҲ3пјүдёҖз§Қз”ІйҶҮзҮғж–ҷз”өжұ жҳҜйҮҮз”Ёй“ӮжҲ–зўіеҢ–й’ЁдҪңз”өжһҒпјҢзЁҖзЎ«й…ёдҪңз”өи§Јж¶ІпјҢдёҖжһҒзӣҙжҺҘеҠ е…ҘзәҜеҢ–еҗҺзҡ„з”ІйҶҮпјҢеҗҢж—¶еҗ‘еҸҰдёҖдёӘз”өжһҒйҖҡе…Ҙз©әж°”пјҺеҲҷз”ІйҶҮиҝӣе…Ҙ жһҒпјҢжӯЈжһҒеҸ‘з”ҹзҡ„з”өжһҒеҸҚеә”ж–№зЁӢејҸдёә пјҺ
CO(g)+ 2H2(g) ![]() CH3OH(g) в–іH
CH3OH(g) в–іH
-
пјҲ1пјү е·ІзҹҘCO(g)гҖҒH2(g)зҡ„ж ҮеҮҶзҮғзғ§зғӯеҲҶеҲ«дёә-283.0kJвҖўmol-1 пјҢ -285.8kJвҖўmol-1
дё”CH3OH(g)+3/2O2(g)
 CO2(g)+2H2O(l) в–іH=пјҚ761 kJвҖўmol-1пјӣ
CO2(g)+2H2O(l) в–іH=пјҚ761 kJвҖўmol-1пјӣеҲҷCO(g)+ 2H2(g)
 CH3OH(g)зҡ„в–іH= гҖӮ
CH3OH(g)зҡ„в–іH= гҖӮ -
пјҲ2пјү еҸҚеә”зҡ„О”S0пјҲеЎ«вҖңпјһвҖқгҖҒвҖңпјңвҖқжҲ–вҖңпјқвҖқпјүгҖӮеңЁпјҲеЎ«вҖңиҫғй«ҳвҖқжҲ–вҖңиҫғдҪҺвҖқпјүжё©еәҰдёӢиҜҘеҸҚеә”иҮӘеҸ‘иҝӣиЎҢгҖӮ
-
пјҲ3пјү иӢҘе°Ҷзӯүзү©иҙЁзҡ„йҮҸзҡ„COе’ҢH2ж··еҗҲж°”дҪ“е……е…ҘжҒ’жё©жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯиҝӣиЎҢдёҠиҝ°еҸҚеә”пјҢдёӢеҲ—дәӢе®һиғҪиҜҙжҳҺжӯӨеҸҚеә”е·ІиҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„жҳҜ гҖӮA . е®№еҷЁеҶ…ж°”дҪ“еҜҶеәҰдҝқжҢҒдёҚеҸҳ B . ж··еҗҲж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёҚеҸҳ C . з”ҹжҲҗCH3OHзҡ„йҖҹзҺҮдёҺз”ҹжҲҗH2зҡ„йҖҹзҺҮзӣёзӯү D . COзҡ„дҪ“з§ҜеҲҶж•°дҝқжҢҒдёҚеҸҳ
-
пјҲ4пјү еӣҫ1дёӯиғҪжӯЈзЎ®еҸҚжҳ е№іиЎЎеёёж•°KйҡҸжё©еәҰеҸҳеҢ–е…ізі»зҡ„жӣІзәҝдёәпјҲз”ЁaжҲ–bиЎЁзӨәпјүгҖӮ
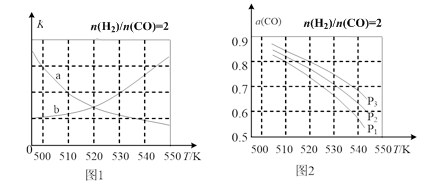
-
пјҲ5пјү жҠ•ж–ҷжҜ”n(H2)/n(CO)=2ж—¶пјҢдҪ“зі»дёӯCOзҡ„е№іиЎЎиҪ¬еҢ–зҺҮ(Оұ)жё©еәҰе’ҢеҺӢејәзҡ„е…ізі»еҰӮеӣҫ2жүҖзӨәгҖӮОұ(CO)еҖјйҡҸжё©еәҰеҚҮй«ҳиҖҢпјҲеЎ«вҖңеўһеӨ§вҖқжҲ–вҖңеҮҸе°ҸвҖқпјүе…¶еҺҹеӣ жҳҜпјӣеӣҫ2дёӯзҡ„еҺӢејәз”ұеӨ§еҲ°е°ҸдёәпјҲз”ЁP1 пјҢ P2 пјҢ P3иЎЁзӨәпјүгҖӮ
-
пјҲ6пјү 520Kж—¶пјҢ жҠ•ж–ҷжҜ”n(H2)/n(CO)=2пјҲжҖ»зү©иҙЁзҡ„йҮҸдёә3molпјүпјҢз»ҙжҢҒеҸҚеә”иҝҮзЁӢдёӯеҺӢејәp3дёҚеҸҳпјҢиҫҫеҲ°е№іиЎЎж—¶жөӢеҫ—е®№еҷЁдҪ“з§Ҝдёә0.1LпјҢеҲҷе№іиЎЎеёёж•°K=гҖӮ
иӢҘH2е’ҢCOзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәnвҲ¶1пјҲз»ҙжҢҒеҸҚеә”иҝҮзЁӢдёӯеҺӢејәp3дёҚеҸҳпјүпјҢзӣёеә”е№іиЎЎдҪ“зі»дёӯCH3OHзҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°дёәx пјҢ иҜ·еңЁеӣҫ3дёӯз»ҳеҲ¶xйҡҸnеҸҳеҢ–зҡ„зӨәж„Ҹеӣҫ гҖӮ

H2пјҲgпјү+Cl2пјҲgпјү=2HClпјҲgпјүв–іH=п№Ј184kJ/mol

иҜ·еӣһзӯ”пјҡ
-
пјҲ1пјү H2дёҺO2еҸҚеә”з”ҹжҲҗж°”жҖҒж°ҙзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸжҳҜгҖӮ
-
пјҲ2пјү ж–ӯејҖ1mol Hп№ЈO й”®жүҖйңҖиғҪйҮҸзәҰдёәkJгҖӮ
 еҲҷзғӯйҮҸеҸҳеҢ–е…ізі»ејҸпјҡ в–іH1+в–іH3+в–іH5=-(в–іH2+в–іH4)
C . в–іHдёҺеҸҚеә”ж–№зЁӢејҸдёӯзҡ„еҢ–еӯҰи®ЎйҮҸж•°пјҢзү©иҙЁзҡ„зҠ¶жҖҒе’ҢеҸҜйҖҶеҸҚеә”еқҮжңүе…і
D . еҗҢжё©еҗҢеҺӢдёӢпјҢ H2( g)+ Cl 2(g)= 2HCl (g)еңЁе…үз…§е’ҢзӮ№зҮғжқЎд»¶дёӢзҡ„в–іHдёҚеҗҢ
еҲҷзғӯйҮҸеҸҳеҢ–е…ізі»ејҸпјҡ в–іH1+в–іH3+в–іH5=-(в–іH2+в–іH4)
C . в–іHдёҺеҸҚеә”ж–№зЁӢејҸдёӯзҡ„еҢ–еӯҰи®ЎйҮҸж•°пјҢзү©иҙЁзҡ„зҠ¶жҖҒе’ҢеҸҜйҖҶеҸҚеә”еқҮжңүе…і
D . еҗҢжё©еҗҢеҺӢдёӢпјҢ H2( g)+ Cl 2(g)= 2HCl (g)еңЁе…үз…§е’ҢзӮ№зҮғжқЎд»¶дёӢзҡ„в–іHдёҚеҗҢ

-
пјҲ1пјү DeaconеҸ‘жҳҺзҡ„зӣҙжҺҘж°§еҢ–жі•дёәпјҡ4HCl(g)+O2(g)
 2Cl2(g)+2H2O(g)гҖӮдёӢеӣҫдёәеҲҡжҖ§е®№еҷЁдёӯпјҢиҝӣж–ҷжө“еәҰжҜ”c(HCl)вҲ¶c(O2)еҲҶеҲ«зӯүдәҺ1вҲ¶1гҖҒ4вҲ¶1гҖҒ7вҲ¶1ж—¶HClе№іиЎЎиҪ¬еҢ–зҺҮйҡҸжё©еәҰеҸҳеҢ–зҡ„е…ізі»пјҡ
2Cl2(g)+2H2O(g)гҖӮдёӢеӣҫдёәеҲҡжҖ§е®№еҷЁдёӯпјҢиҝӣж–ҷжө“еәҰжҜ”c(HCl)вҲ¶c(O2)еҲҶеҲ«зӯүдәҺ1вҲ¶1гҖҒ4вҲ¶1гҖҒ7вҲ¶1ж—¶HClе№іиЎЎиҪ¬еҢ–зҺҮйҡҸжё©еәҰеҸҳеҢ–зҡ„е…ізі»пјҡ 
еҸҜзҹҘеҸҚеә”е№іиЎЎеёёж•°K(300в„ғ)K(400в„ғ)(еЎ«вҖңеӨ§дәҺвҖқгҖҒвҖңзӯүдәҺвҖқжҲ–вҖңе°ҸдәҺвҖқ)гҖӮи®ҫHClеҲқе§Ӣжө“еәҰдёәc0 пјҢ ж №жҚ®иҝӣж–ҷжө“еәҰжҜ”c(HCl)вҲ¶c(O2)=1вҲ¶1зҡ„ж•°жҚ®и®Ўз®—K(400в„ғ)=пјҲеҲ—еҮәи®Ўз®—ејҸпјүгҖӮжҢүеҢ–еӯҰи®ЎйҮҸжҜ”иҝӣж–ҷеҸҜд»ҘдҝқжҢҒеҸҚеә”зү©й«ҳиҪ¬еҢ–зҺҮпјҢеҗҢж—¶йҷҚдҪҺдә§зү©еҲҶзҰ»зҡ„иғҪиҖ—гҖӮиҝӣж–ҷжө“еәҰжҜ”c(HCl)вҲ¶c(O2)иҝҮдҪҺгҖҒиҝҮй«ҳзҡ„дёҚеҲ©еҪұе“ҚеҲҶеҲ«жҳҜгҖҒгҖӮ
-
пјҲ2пјү DeaconзӣҙжҺҘж°§еҢ–жі•еҸҜжҢүдёӢеҲ—еӮ¬еҢ–иҝҮзЁӢиҝӣиЎҢпјҡ
CuCl2(s)=CuCl(s)+
 Cl2(g) О”H1=+83 kJВ·molпјҚ1
Cl2(g) О”H1=+83 kJВ·molпјҚ1CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+  Cl2(g) О”H2=-20 kJВ·molпјҚ1
Cl2(g) О”H2=-20 kJВ·molпјҚ1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) О”H3=-121 kJВ·molпјҚ1
еҲҷ4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)зҡ„О”H= kJВ·molпјҚ1гҖӮ
-
пјҲ1пјү ж°Ёж°”иҝҳеҺҹж°®ж°§еҢ–зү©зҡ„еҸҚеә”дёәпјҡ
в‘ N2(g)+O2(g)=2NO(g) в–іH1
в‘Ў4NH3(g)+3O2(g)=2N2(g)+6H2O(l) в–іH2
еҲҷ4NH3(g)+6NO(g)=5N2(g)+6H2O(1) в–іH=гҖӮ(з”Ёеҗ«в–іH1гҖҒв–іH2зҡ„ејҸеӯҗиЎЁзӨә)
дҫқжҚ®еҸҚеә”в‘ЎпјҢе°Ҷж°Ёж°”и®ҫи®ЎжҲҗзҮғж–ҷз”өжұ пјҢз”ЁKOHжә¶ж¶ІдҪңз”өи§ЈиҙЁжә¶ж¶ІпјҢеҶҷеҮәиҙҹжһҒз”өжһҒеҸҚеә”ејҸпјҡгҖӮ
-
пјҲ2пјү дёҖе®ҡжё©еәҰдёӢпјҢеҗ‘2LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯе……4.0molNO2е’Ң4.0mol COпјҢеңЁеӮ¬еҢ–еүӮдҪңз”ЁдёӢеҸ‘з”ҹеҸҚеә”4CO(g)+2NO2(g)вҮҢN2(g)+4CO2(g) в–іHпјң0пјҢжөӢеҫ—зӣёе…іж•°жҚ®еҰӮиЎЁпјҡ
0min
5min
10min
15min
20min
c(NO2)/molвӢ…LвҲ’1
2.0
1.7
1.56
1.5
1.5
c(N2)/molвӢ…LвҲ’1
0
0.15
0.22
0.25
0.25
в‘ 0вҲј5minпјҢз”ЁNO2зҡ„жө“еәҰеҸҳеҢ–иЎЁзӨәзҡ„еҸҚеә”йҖҹзҺҮдёәгҖӮ
в‘Ўд»ҘдёӢиЎЁиҝ°иғҪиҜҙжҳҺиҜҘеҸҚеә”е·ұиҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„жҳҜгҖӮ
A.2v(NO2)жӯЈ=v(N2)йҖҶ BпјҺж°”дҪ“еҜҶеәҰдёҚеҶҚеҸҳеҢ–
CпјҺж°”дҪ“е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёҚеҶҚеҸҳеҢ– DпјҺN2дёҺCO2зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дҝқжҢҒдёҚеҸҳ
в‘ў20minж—¶пјҢдҝқжҢҒжё©еәҰдёҚеҸҳпјҢ继з»ӯеҗ‘иҜҘе®№еҷЁдёӯеҠ е…Ҙ1.0molNO2е’Ң1.0molCOпјҢеҸҚеә”еҶҚж¬ЎиҫҫеҲ°е№іиЎЎж—¶пјҢNO2зҡ„иҪ¬еҢ–зҺҮжҜ”еҺҹе№іиЎЎ(еЎ«вҖңеўһеӨ§вҖқгҖҒвҖңеҮҸе°ҸвҖқжҲ–вҖңдёҚеҸҳ)гҖӮ
в‘ЈиҜҘжё©еәҰдёӢеҸҚеә”зҡ„еҢ–еӯҰе№іиЎЎеёёж•°K=гҖӮ
-
пјҲ3пјү ж№ҝжі•и„ұзЎқпјҡйҮҮз”ЁNaClO2жә¶ж¶ІдҪңдёәеҗёж”¶еүӮеҸҜеҜ№зғҹж°”иҝӣиЎҢи„ұзЎқгҖӮ323KдёӢпјҢеҗ‘и¶ійҮҸзўұжҖ§NaClO2жә¶ж¶ІдёӯйҖҡе…Ҙеҗ«NOзҡ„зғҹж°”пјҢе……еҲҶеҸҚеә”еҗҺпјҢжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰзҡ„еҲҶжһҗз»“жһңеҰӮиЎЁпјҡ
зҰ»еӯҗ
NO3вҲ’
NO2вҲ’
ClвҲ’
c/(molвӢ…LвҲ’1)
2.0Г—10вҲ’4
1.0Г—10вҲ’4
1.75Г—10вҲ’4
в‘ NaClO2жә¶ж¶ІжҳҫзўұжҖ§пјҢз”ЁзҰ»еӯҗж–№зЁӢејҸи§ЈйҮҠеҺҹеӣ гҖӮ
в‘ЎдҫқжҚ®иЎЁдёӯж•°жҚ®пјҢеҶҷеҮәNaClO2жә¶ж¶Іи„ұзЎқиҝҮзЁӢдёӯеҸ‘з”ҹжҖ»еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ
-
пјҲ1пјү I.еҲ©з”Ёз”Ізғ·зҡ„иҝҳеҺҹжҖ§пјҢеҸҜд»ҘеҜ№еӨ§ж°”дёӯзҡ„ж°®ж°§еҢ–еҗҲзү©иҝӣиЎҢеӨ„зҗҶгҖӮе·ІзҹҘдёҖе®ҡжқЎд»¶дёӢпјҡ
в‘ 4NO2(g)+2N2(g)=8NO(g)в–іH1=+586kJВ·mol-1
в‘ЎCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)в–іH2=-1160kJВ·mol-1
еҲҷCH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)в–іH=kJВ·mol-1 пјҢ иҜҘеҸҚеә”(еЎ«вҖңиғҪвҖқжҲ–вҖңдёҚиғҪвҖқ)иҮӘеҸ‘иҝӣиЎҢгҖӮ
-
пјҲ2пјү II.еҲ©з”ЁCH4еҸҜеҲ¶еӨҮеҗҲжҲҗж°”пјҢеҸҚеә”дёәCO2(g)+CH4(g)
 2CO(g)+2H2(g)пјҢеңЁдёҖе®ҡжқЎд»¶дёӢпјҢеңЁжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯйҖҡе…ҘCH4дёҺCO2 пјҢ дҪҝе…¶еҲқе§Ӣзү©иҙЁзҡ„йҮҸжө“еәҰеқҮдёә1.0molВ·L-1 пјҢ жөӢеҫ—CH4зҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёҺжё©еәҰеҸҠеҺӢејәзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҡ
2CO(g)+2H2(g)пјҢеңЁдёҖе®ҡжқЎд»¶дёӢпјҢеңЁжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯйҖҡе…ҘCH4дёҺCO2 пјҢ дҪҝе…¶еҲқе§Ӣзү©иҙЁзҡ„йҮҸжө“еәҰеқҮдёә1.0molВ·L-1 пјҢ жөӢеҫ—CH4зҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёҺжё©еәҰеҸҠеҺӢејәзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҡ 
иҜҘеҸҚеә”зҡ„в–іH0(еЎ«вҖң>вҖқгҖҒвҖң<вҖқжҲ–вҖң=вҖқ)гҖӮ
-
пјҲ3пјү дёӢеҲ—жҸҸиҝ°иғҪиҜҙжҳҺдёҠиҝ°еҸҚеә”е·ІиҫҫеҲ°еҢ–еӯҰе№іиЎЎзҠ¶жҖҒзҡ„жҳҜ(йҖүеЎ«еәҸеҸ·)гҖӮ
в‘ 2v(CO2)=v(CO)
в‘Ўе®№еҷЁдёӯж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдёҚйҡҸж—¶й—ҙиҖҢеҸҳеҢ–
в‘ўе®№еҷЁдёӯж°”дҪ“еҺӢејәдёҚйҡҸж—¶й—ҙиҖҢеҸҳеҢ–
в‘Је®№еҷЁдёӯж··еҗҲж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёҚйҡҸж—¶й—ҙиҖҢеҸҳеҢ–
-
пјҲ4пјү еҺӢејәp1гҖҒp2гҖҒp3гҖҒp4з”ұеӨ§еҲ°е°Ҹзҡ„е…ізі»дёәгҖӮеҺӢејәдёәp4ж—¶пјҢеңЁbзӮ№пјҡv(жӯЈ)v(йҖҶ)(еЎ«вҖң>вҖқгҖҒвҖң<вҖқжҲ–вҖң=вҖқ)гҖӮ
-
пјҲ5пјү еҜ№дәҺж°”зӣёеҸҚеә”пјҢз”Ёжҹҗз»„еҲҶ(B)зҡ„е№іиЎЎеҺӢејәp(B)д»Јжӣҝе…¶е№іиЎЎж—¶зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰc(B)д№ҹеҸҜиЎЁзӨәе№іиЎЎеёёж•°(и®°дҪңKp)пјҢиӢҘp4=0.36MPaпјҢжұӮaзӮ№зҡ„е№іиЎЎеёёж•°Kp=(MPa)2(дҝқз•ҷ3дҪҚжңүж•Ҳж•°еӯ—пјҢз”Ёе№іиЎЎеҲҶеҺӢд»Јжӣҝе№іиЎЎжө“еәҰи®Ўз®—пјҢеҲҶеҺӢ=жҖ»еҺӢГ—зү©иҙЁзҡ„йҮҸеҲҶж•°)гҖӮ
-
пјҲ6пјү иӢҘ1100в„ғгҖҒp4еҺӢејәдёӢеҸҚеә”иҫҫе№іиЎЎеҗҺпјҢеҶҚе……е…Ҙзӯүзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„CH4дёҺCO2 пјҢ еҲҷCH4зҡ„е№іиЎЎиҪ¬еҢ–зҺҮ80%(еЎ«вҖң>вҖқгҖҒвҖң<вҖқжҲ–вҖң=вҖқ)гҖӮ
еҸҚеә”в… пјҡCaSO4(s)+CO(g)вҮҢCaO(s)+SO2(g)+CO2(g)жҙ»еҢ–иғҪEa1 пјҢ О”H1=+218.4kJВ·mol-1
еҸҚеә”в…ЎпјҡCaSO4(s)+4CO(g)вҮҢCaS(s)+4CO2(g)жҙ»еҢ–иғҪEa2 пјҢ О”H2=-175.6kJВ·mol-1
е·ІзҹҘжҙ»еҢ–иғҪEa1< Ea2гҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү еҸҚеә”CaO(s)+3CO(g)+SO2(g)вҮҢCaS(s)+3CO2(g)пјӣв–іH=kJвҖўmol-1пјӣиҜҘеҸҚеә”еңЁ(еЎ«вҖңй«ҳжё©вҖқвҖңдҪҺжё©вҖқвҖңд»»ж„Ҹжё©еәҰвҖқ)ж—¶еҸҜиҮӘеҸ‘иҝӣиЎҢгҖӮ
-
пјҲ2пјү жҒ’жё©еҜҶй—ӯе®№еҷЁдёӯпјҢеҠ е…Ҙи¶ійҮҸCaSO4е’ҢдёҖе®ҡзү©иҙЁзҡ„йҮҸзҡ„COж°”дҪ“пјҢжӯӨж—¶еҺӢејәдёәp0гҖӮt minдёӯж—¶еҸҚеә”иҫҫеҲ°е№іиЎЎпјҢжӯӨж—¶COе’ҢCO2дҪ“з§ҜеҲҶж•°зӣёзӯүпјҢCO2жҳҜSO2дҪ“з§ҜеҲҶж•°зҡ„2еҖҚпјҢеҲҷеҸҚеә”Iзҡ„е№іиЎЎеёёж•°Kp=(еҜ№дәҺж°”зӣёеҸҚеә”пјҢз”Ёжҹҗз»„еҲҶBзҡ„е№іиЎЎеҺӢејәp(B)д»Јжӣҝзү©иҙЁзҡ„йҮҸжө“еәҰc(B)д№ҹеҸҜиЎЁзӨәе№іиЎЎеёёж•°пјҢи®°дҪңKp пјҢ еҰӮp(B)=pВ·x(B)пјҢpдёәе№іиЎЎжҖ»еҺӢејәпјҢx(B)дёәе№іиЎЎзі»з»ҹдёӯBзҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°)гҖӮ
-
пјҲ3пјү дёӢеӣҫдёә1000 Kж—¶пјҢеңЁжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯеҗҢж—¶еҸ‘з”ҹеҸҚеә”Iе’ҢIIпјҢc(SO2)йҡҸж—¶й—ҙзҡ„еҸҳеҢ–еӣҫиұЎгҖӮиҜ·еҲҶжһҗдёӢеӣҫжӣІзәҝдёӯc(SO2)еңЁ0пҪһt2еҢәй—ҙеҸҳеҢ–зҡ„еҺҹеӣ гҖӮ

-
пјҲ4пјү дёӢеӣҫдёәе®һйӘҢеңЁжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯпјҢжөӢеҫ—дёҚеҗҢжё©еәҰдёӢпјҢеҸҚеә”дҪ“зі»дёӯеҲқе§Ӣжө“еәҰжҜ”
 дёҺSO2дҪ“з§ҜеҲҶж•°зҡ„е…ізі»жӣІзәҝгҖӮдёӢеҲ—жңүе…іеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ_______гҖӮ(еЎ«еәҸеҸ·)
дёҺSO2дҪ“з§ҜеҲҶж•°зҡ„е…ізі»жӣІзәҝгҖӮдёӢеҲ—жңүе…іеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ_______гҖӮ(еЎ«еәҸеҸ·)  A . еҪ“дҪ“зі»дёӯж°”дҪ“зҡ„еҜҶеәҰдёҚеҶҚеҸҳеҢ–ж—¶пјҢеҸҚеә”Iе’ҢеҸҚеә”в…ЎйғҪе·ІиҫҫеҲ°е№іиЎЎзҠ¶жҖҒ B . жҸҗй«ҳCaSO4зҡ„з”ЁйҮҸпјҢеҸҜдҪҝеҸҚеә”IжӯЈеҗ‘иҝӣиЎҢпјҢSO2дҪ“з§ҜеҲҶж•°еўһеӨ§ C . е…¶д»–жқЎд»¶дёҚеҸҳпјҢеҚҮй«ҳжё©еәҰпјҢжңүеҲ©дәҺеҸҚеә”IжӯЈеҗ‘иҝӣиЎҢпјҢSO2дҪ“з§ҜеҲҶж•°еўһеӨ§пјҢдёҚеҲ©дәҺи„ұзЎ«
A . еҪ“дҪ“зі»дёӯж°”дҪ“зҡ„еҜҶеәҰдёҚеҶҚеҸҳеҢ–ж—¶пјҢеҸҚеә”Iе’ҢеҸҚеә”в…ЎйғҪе·ІиҫҫеҲ°е№іиЎЎзҠ¶жҖҒ B . жҸҗй«ҳCaSO4зҡ„з”ЁйҮҸпјҢеҸҜдҪҝеҸҚеә”IжӯЈеҗ‘иҝӣиЎҢпјҢSO2дҪ“з§ҜеҲҶж•°еўһеӨ§ C . е…¶д»–жқЎд»¶дёҚеҸҳпјҢеҚҮй«ҳжё©еәҰпјҢжңүеҲ©дәҺеҸҚеә”IжӯЈеҗ‘иҝӣиЎҢпјҢSO2дҪ“з§ҜеҲҶж•°еўһеӨ§пјҢдёҚеҲ©дәҺи„ұзЎ«
-
пјҲ1пјү COеҸҜз”ЁдәҺзӮјй“ҒпјҢе·ІзҹҘпјҡFe2O3пјҲsпјү+3CпјҲsпјүпјқ2FeпјҲsпјү+3COпјҲgпјү О”H1пјқ+489.0 kJВ·molвҖ“1пјӣCпјҲsпјү+CO2пјҲgпјүпјқ2COпјҲgпјү О”H2пјқ+172.5 kJВ·molвҖ“1гҖӮеҲҷCOиҝҳеҺҹFe2O3пјҲsпјүзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
-
пјҲ2пјү й«ҳжё©з”өи§ЈжҠҖжңҜиғҪй«ҳж•Ҳе®һзҺ°дёӢеҲ—еҸҚеә”пјҡCO2+H2O
 CO+H2+O2 пјҢ е…¶еҸҜе°ҶCO2иҪ¬еҢ–дёәе…·жңүе·ҘдёҡеҲ©з”Ёд»·еҖјзҡ„дә§е“ҒпјҢе·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәпјҢз”өжһҒaзҡ„з”өжһҒеҸҚеә”ејҸгҖӮ
CO+H2+O2 пјҢ е…¶еҸҜе°ҶCO2иҪ¬еҢ–дёәе…·жңүе·ҘдёҡеҲ©з”Ёд»·еҖјзҡ„дә§е“ҒпјҢе·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәпјҢз”өжһҒaзҡ„з”өжһҒеҸҚеә”ејҸгҖӮ 
-
пјҲ3пјү CO2е’ҢH2е……е…ҘдёҖе®ҡдҪ“з§Ҝзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢеңЁдёӨз§Қжё©еәҰдёӢеҸ‘з”ҹеҸҚеә”пјҡCO2пјҲgпјү+3H2пјҲgпјүвҮҢCH3OHпјҲgпјү+H2OпјҲgпјүпјҢжөӢеҫ—CH3OHзҡ„зү©иҙЁзҡ„йҮҸйҡҸж—¶й—ҙзҡ„еҸҳеҢ–еҰӮеӣҫгҖӮ

в‘ жӣІзәҝIгҖҒв…ЎеҜ№еә”зҡ„е№іиЎЎеёёж•°еӨ§е°Ҹе…ізі»дёәKв… Kв…ЎпјҲеЎ«вҖңпјһжҲ–пјқжҲ–пјңвҖқпјүгҖӮ
в‘ЎдёҖе®ҡжё©еәҰдёӢпјҢжӯӨеҸҚеә”еңЁжҒ’еҺӢе®№еҷЁдёӯиҝӣиЎҢпјҢиғҪеҲӨж–ӯиҜҘеҸҚеә”иҫҫеҲ°еҢ–еӯҰе№іиЎЎзҠ¶жҖҒзҡ„дҫқжҚ®жҳҜгҖӮ
a.е®№еҷЁдёӯеҺӢејәдёҚеҸҳ
b.H2зҡ„дҪ“з§ҜеҲҶж•°дёҚеҸҳ
c.cпјҲH2пјүпјқ3cпјҲCH3OHпјү
d.е®№еҷЁдёӯеҜҶеәҰдёҚеҸҳ
e.2дёӘCпјқOж–ӯиЈӮзҡ„еҗҢж—¶жңү3дёӘH-Hж–ӯиЈӮ
в‘ўдёҖе®ҡжё©еәҰдёӢпјҢеңЁе®№з§ҜзӣёеҗҢдё”еӣәе®ҡзҡ„дёӨдёӘеҜҶй—ӯе®№еҷЁдёӯпјҢжҢүеҰӮдёӢж–№ејҸеҠ е…ҘеҸҚеә”зү©пјҢдёҖж®өж—¶й—ҙеҗҺиҫҫеҲ°е№іиЎЎгҖӮ
е®№еҷЁ
з”І
д№ҷ
еҸҚеә”зү©жҠ•е…ҘйҮҸ
1mol CO2гҖҒ3mol H2
amol CO2гҖҒbmol H2гҖҒcmol CH3OHпјҲgпјүгҖҒcmol H2OпјҲgпјү
иӢҘз”Ідёӯе№іиЎЎеҗҺж°”дҪ“зҡ„еҺӢејәдёәејҖе§Ӣзҡ„0.8еҖҚпјҢиҰҒдҪҝе№іиЎЎеҗҺд№ҷдёҺз”ІдёӯзӣёеҗҢз»„еҲҶзҡ„дҪ“з§ҜеҲҶж•°зӣёзӯүпјҢдё”иө·е§Ӣж—¶з»ҙжҢҒеҢ–еӯҰеҸҚеә”еҗ‘йҖҶеҸҚеә”ж–№еҗ‘иҝӣиЎҢпјҢеҲҷcзҡ„еҸ–еҖјиҢғеӣҙдёәгҖӮ
-
пјҲ4пјү е·Ҙдёҡз”ҹдә§зғҹж°”дёӯзҡ„CO2жҚ•иҺ·жҠҖжңҜд№ӢдёҖжҳҜж°Ёж°ҙжә¶ж¶Іеҗёж”¶жҠҖжңҜпјҢе°Ҷзғҹж°”еҶ·еҚҙиҮі15.5в„ғпҪһ26.5в„ғеҗҺз”Ёж°Ёж°ҙеҗёж”¶иҝҮйҮҸзҡ„CO2гҖӮе·ІзҹҘпјҡNH3В·H2Oзҡ„Kb=1.7Г—10вҖ“5 пјҢ H2CO3зҡ„Ka1=4.3Г—10вҖ“7гҖҒKa2=5.6Г—10вҖ“11гҖӮеҗёж”¶еҗҺжүҖеҫ—жә¶ж¶Ізҡ„pH7пјҲеЎ«вҖңпјһгҖҒ=жҲ–пјңвҖқпјүгҖӮ
-
пјҲ1пјү ж°®ж°§еҢ–зү©жҳҜйҖ жҲҗе…үеҢ–еӯҰжұЎжҹ“зҡ„зҪӘйӯҒзҘёйҰ–пјҢз”ЁдёҖж°§еҢ–зўіиҝҳеҺҹж°®ж°§еҢ–зү©пјҢеҸҜйҳІжӯўж°®ж°§еҢ–зү©жұЎжҹ“пјҢеҰӮеҸҚеә”пјҡ
 гҖӮ
гҖӮ е·ІзҹҘпјҡi.зўізҡ„зҮғзғ§зғӯдёә
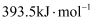
ii.
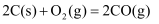

iii.


еҲҷ
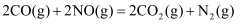
 гҖӮ
гҖӮ -
пјҲ2пјү е·ІзҹҘпјҡ
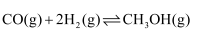
 гҖӮе°Ҷ1mol COе’Ң
гҖӮе°Ҷ1mol COе’Ң  е……е…Ҙ1LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯпјҢеңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҸҚеә”пјҢзӣёеҗҢж—¶й—ҙеҶ…жөӢеҫ—COзҡ„иҪ¬еҢ–зҺҮдёҺжё©еәҰзҡ„еҜ№еә”е…ізі»еҰӮеӣҫжүҖзӨәпјҡ
е……е…Ҙ1LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯпјҢеңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҸҚеә”пјҢзӣёеҗҢж—¶й—ҙеҶ…жөӢеҫ—COзҡ„иҪ¬еҢ–зҺҮдёҺжё©еәҰзҡ„еҜ№еә”е…ізі»еҰӮеӣҫжүҖзӨәпјҡ 
в‘
 0(еЎ«вҖңпјһвҖқжҲ–вҖңпјңвҖқ)гҖӮ
0(еЎ«вҖңпјһвҖқжҲ–вҖңпјңвҖқ)гҖӮв‘ЎиғҪеҗҰж №жҚ®aзӮ№COзҡ„иҪ¬еҢ–зҺҮдёә50%жұӮз®—еҸҚеә”
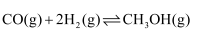 зҡ„е№іиЎЎеёёж•°Kпјҡ(еЎ«вҖңиғҪвҖқжҲ–вҖңдёҚиғҪвҖқ)пјҢзҗҶз”ұжҳҜгҖӮ
зҡ„е№іиЎЎеёёж•°Kпјҡ(еЎ«вҖңиғҪвҖқжҲ–вҖңдёҚиғҪвҖқ)пјҢзҗҶз”ұжҳҜгҖӮв‘ўе·ІзҹҘcзӮ№ж—¶е®№еҷЁеҶ…зҡ„еҺӢејәдёәpпјҢеңЁ
 жё©еәҰдёӢиҜҘеҸҚеә”зҡ„еҺӢејәе№іиЎЎеёёж•°
жё©еәҰдёӢиҜҘеҸҚеә”зҡ„еҺӢејәе№іиЎЎеёёж•°  дёә(з”Ёеҗ«pзҡ„е…ізі»ејҸиЎЁзӨә)гҖӮ(
дёә(з”Ёеҗ«pзҡ„е…ізі»ејҸиЎЁзӨә)гҖӮ(  дёәд»ҘеҲҶеҺӢиЎЁзӨәзҡ„е№іиЎЎеёёж•°пјҢеҲҶеҺӢ=жҖ»еҺӢГ—зү©иҙЁзҡ„йҮҸеҲҶж•°)
дёәд»ҘеҲҶеҺӢиЎЁзӨәзҡ„е№іиЎЎеёёж•°пјҢеҲҶеҺӢ=жҖ»еҺӢГ—зү©иҙЁзҡ„йҮҸеҲҶж•°) -
пјҲ3пјү еңЁз»қзғӯзҡ„жҹҗеҲҡжҖ§е®№еҷЁдёӯзҪ®е…Ҙ
 е’Ң
е’Ң  пјҢеҸ‘з”ҹеҸҚеә”пјҡ
пјҢеҸ‘з”ҹеҸҚеә”пјҡ 
 гҖӮдёӢеҲ—иҜҙжі•дёӯиғҪеӨҹеҲӨж–ӯиҜҘеҸҚеә”дёҖе®ҡеӨ„дәҺе№іиЎЎзҠ¶жҖҒзҡ„жңү(еЎ«ж•°еӯ—еәҸеҸ·)гҖӮ
гҖӮдёӢеҲ—иҜҙжі•дёӯиғҪеӨҹеҲӨж–ӯиҜҘеҸҚеә”дёҖе®ҡеӨ„дәҺе№іиЎЎзҠ¶жҖҒзҡ„жңү(еЎ«ж•°еӯ—еәҸеҸ·)гҖӮ в‘ е®№еҷЁдёӯ
 гҖҒ
гҖҒ  гҖҒ
гҖҒ  е…ұеӯҳ
е…ұеӯҳв‘ЎеҚ•дҪҚж—¶й—ҙеҶ…з”ҹжҲҗ
 зҡ„еҗҢж—¶ж¶ҲиҖ—
зҡ„еҗҢж—¶ж¶ҲиҖ— 
в‘ў
 дёҺ
дёҺ  жө“еәҰд№ӢжҜ”жҒ’е®ҡдёҚеҸҳ
жө“еәҰд№ӢжҜ”жҒ’е®ҡдёҚеҸҳв‘Је®№еҷЁдёӯжё©еәҰжҒ’е®ҡдёҚеҸҳ
в‘Өе®№еҷЁдёӯ
 гҖҒ
гҖҒ  гҖҒ
гҖҒ  зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә2вҲ¶1вҲ¶2
зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә2вҲ¶1вҲ¶2в‘ҘеҸҚеә”е®№еҷЁдёӯеҺӢејәдёҚйҡҸж—¶й—ҙеҸҳеҢ–
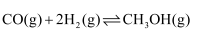
 гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү е·ІзҹҘ




йғЁеҲҶеҢ–еӯҰй”®зҡ„й”®иғҪеҰӮиЎЁжүҖзӨәгҖӮ
еҢ–еӯҰй”®
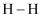
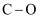

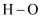
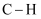

436
351
1076
463
x
еҲҷ
 гҖӮ
гҖӮ -
пјҲ2пјү иӢҘжҢү
 жҠ•ж–ҷпјҢе°ҶHдёҺCOе……е…ҘV LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯпјҢеңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҸҚеә”пјҢжөӢеҫ—COзҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёҺжё©еәҰгҖҒеҺӢејәзҡ„е…ізі»еҰӮеӣҫ1жүҖзӨәгҖӮ
жҠ•ж–ҷпјҢе°ҶHдёҺCOе……е…ҘV LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯпјҢеңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҸҚеә”пјҢжөӢеҫ—COзҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёҺжё©еәҰгҖҒеҺӢејәзҡ„е…ізі»еҰӮеӣҫ1жүҖзӨәгҖӮ 
е·ІзҹҘпјҡ
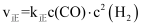 пјҢ
пјҢ  пјҢе…¶дёӯ
пјҢе…¶дёӯ  гҖҒ
гҖҒ  дёәйҖҹзҺҮеёёж•°пјҢеҸӘдёҺжё©еәҰжңүе…ігҖӮ
дёәйҖҹзҺҮеёёж•°пјҢеҸӘдёҺжё©еәҰжңүе…ігҖӮв‘ еҺӢејә
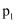 гҖҒ
гҖҒ  гҖҒ
гҖҒ  з”ұе°ҸеҲ°еӨ§зҡ„йЎәеәҸжҳҜгҖӮ
з”ұе°ҸеҲ°еӨ§зҡ„йЎәеәҸжҳҜгҖӮв‘Ў
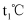 гҖҒеҺӢејәдёә
гҖҒеҺӢејәдёә  ж—¶пјҢиӢҘеҗ‘иҜҘе®№еҷЁдёӯе……е…Ҙ
ж—¶пјҢиӢҘеҗ‘иҜҘе®№еҷЁдёӯе……е…Ҙ 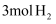 е’Ң3mol COеҸ‘з”ҹеҸҚеә”пјҢ5minеҗҺеҸҚеә”иҫҫеҲ°е№іиЎЎ(MзӮ№)пјҢеҲҷ0~5minеҶ…пјҢ
е’Ң3mol COеҸ‘з”ҹеҸҚеә”пјҢ5minеҗҺеҸҚеә”иҫҫеҲ°е№іиЎЎ(MзӮ№)пјҢеҲҷ0~5minеҶ…пјҢ 
 пјҢNзӮ№ж—¶зҡ„
пјҢNзӮ№ж—¶зҡ„  гҖӮ
гҖӮв‘ўXгҖҒYгҖҒMгҖҒNеӣӣзӮ№еҜ№еә”зҡ„е№іиЎЎеёёж•°д»ҺеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜгҖӮ
-
пјҲ3пјү иӢҘеҗ‘иө·е§Ӣжё©еәҰдёә325в„ғзҡ„10LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯе……е…Ҙ2mol COе’Ң
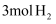 пјҢеҸ‘з”ҹеҸҚеә”пјҢдҪ“зі»жҖ»еҺӢејә(p)дёҺж—¶й—ҙ(t)зҡ„е…ізі»еҰӮеӣҫ2дёӯжӣІзәҝв… жүҖзӨәпјҢжӣІзәҝв…ЎдёәеҸӘж”№еҸҳжҹҗдёҖжқЎд»¶зҡ„еҸҳеҢ–жӣІзәҝгҖӮе№іиЎЎж—¶жё©еәҰдёҺиө·е§Ӣжё©еәҰзӣёеҗҢгҖӮ
пјҢеҸ‘з”ҹеҸҚеә”пјҢдҪ“зі»жҖ»еҺӢејә(p)дёҺж—¶й—ҙ(t)зҡ„е…ізі»еҰӮеӣҫ2дёӯжӣІзәҝв… жүҖзӨәпјҢжӣІзәҝв…ЎдёәеҸӘж”№еҸҳжҹҗдёҖжқЎд»¶зҡ„еҸҳеҢ–жӣІзәҝгҖӮе№іиЎЎж—¶жё©еәҰдёҺиө·е§Ӣжё©еәҰзӣёеҗҢгҖӮ 
в‘ жӣІзәҝв…ЎжүҖеҜ№еә”зҡ„ж”№еҸҳзҡ„жқЎд»¶еҸҜиғҪдёәгҖӮ
в‘ЎдҪ“зі»жҖ»еҺӢејәе…ҲеўһеӨ§еҗҺеҮҸе°Ҹзҡ„еҺҹеӣ дёәгҖӮ
в‘ўиҜҘжқЎд»¶дёӢ
 зҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёә%(з»“жһңдҝқз•ҷдёүдҪҚжңүж•Ҳж•°еӯ—)гҖӮ
зҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёә%(з»“жһңдҝқз•ҷдёүдҪҚжңүж•Ҳж•°еӯ—)гҖӮ
-
пјҲ1пјү в… .жңҖиҝ‘еҮ е№ҙпјҢжҲ‘еӣҪеҢ—ж–№дёҚе°‘еҹҺеёӮеұ…ж°‘вҖңи°ҲйңҫиүІеҸҳвҖқпјҢжұҪиҪҰе°ҫж°”жҳҜйӣҫйңҫзҡ„зҪӘйӯҒд№ӢдёҖгҖӮжұҪиҪҰе°ҫж°”еҮҖеҢ–зҡ„еҺҹзҗҶдёәпјҡ2CO(g)+2NO(g)=2CO2(g)+N2(g) в–іH=-746.5kJвҖўmol-1гҖӮ
е·ІзҹҘN2(g)+O2(g)
 2NO(g) в–іH=+180.5kJвҖўmol-1 пјҢ еҲҷиЎЁзӨәCOзҮғзғ§зғӯзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
2NO(g) в–іH=+180.5kJвҖўmol-1 пјҢ еҲҷиЎЁзӨәCOзҮғзғ§зғӯзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәгҖӮ -
пјҲ2пјү жҹҗжё©еәҰдёӢпјҢеңЁжҒ’е®№зҡ„еҜҶй—ӯе®№еҷЁдёӯйҖҡе…ҘNOе’ҢCOпјҢжөӢеҫ—дёҚеҗҢж—¶й—ҙзҡ„NOе’ҢCOзҡ„жө“еәҰеҰӮиЎЁпјҡ
ж—¶й—ҙ/s
0
1
2
3
4
5
c(NO)/Г—10-3molвҖўL-1
1.00
0.45
0.25
0.15
0.10
0.10
c(CO)/Г—10-3molвҖўL-1
3.60
3.05
2.85
2.75
2.70
2.70
в‘ 0~2sеҶ…з”ЁN2иЎЁзӨәзҡ„еҢ–еӯҰеҸҚеә”йҖҹзҺҮдёәгҖӮиҜҘжё©еәҰдёӢпјҢCOзҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёәгҖӮ
в‘Ўе®һйӘҢжөӢеҫ—пјҢиҜҘеҸҚеә”зҡ„еҸҚеә”еҺҶзЁӢеҰӮеӣҫпјҢе…¶дёӯжҙ»еҢ–иғҪзӣёеҜ№иҫғеӨ§зҡ„жҳҜ第жӯҘ(еЎ«вҖңдёҖвҖқжҲ–вҖңдәҢвҖқ)гҖӮ
第дёҖжӯҘпјҡ
 +CвҖ”OвҶ’
+CвҖ”OвҶ’  (ж…ўеҸҚеә”)
(ж…ўеҸҚеә”)第дәҢжӯҘпјҡ
 вҶ’NвҖ”O+CвҖ”OвҖ”C(еҝ«еҸҚеә”)
вҶ’NвҖ”O+CвҖ”OвҖ”C(еҝ«еҸҚеә”) -
пјҲ3пјү жҹҗз ”з©¶е°Ҹз»„еңЁе®һйӘҢе®Өд»ҘиҖҗй«ҳжё©иҜ•еүӮAgвҖ”ZSWвҖ”5еӮ¬еҢ–пјҢжөӢеҫ—NOеңЁжңүж— COзҡ„жқЎд»¶дёӢиҪ¬еҢ–дёәN2зҡ„иҪ¬еҢ–зҺҮйҡҸжё©еәҰеҸҳеҢ–жғ…еҶөеҰӮеӣҫжүҖзӨәпјҡ

еңЁ
 =1жқЎд»¶дёӢпјҢйҖүжӢ©жё©еәҰжҺ§еҲ¶еңЁ870Kзҡ„зҗҶз”ұжҳҜгҖӮ
=1жқЎд»¶дёӢпјҢйҖүжӢ©жё©еәҰжҺ§еҲ¶еңЁ870Kзҡ„зҗҶз”ұжҳҜгҖӮ -
пјҲ4пјү дёҖе®ҡжё©еәҰдёӢпјҢеңЁжҒ’е®№еҸҚеә”еҷЁдёӯеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡCO(g)+NO2(g)=CO2(g)+NO(g)пјҢеҢ–еӯҰеҸҚеә”йҖҹзҺҮv=kpm(CO)pn(NO2)(kдёәеҢ–еӯҰеҸҚеә”йҖҹзҺҮеёёж•°пјҢеҸӘдёҺжё©еәҰжңүе…і)гҖӮе®һйӘҢжөӢеҫ—иҜҘжё©еәҰдёӢеҸҚеә”зү©зҡ„еҲҶеҺӢдёҺеҢ–еӯҰеҸҚеә”йҖҹзҺҮзҡ„е…ізі»еҰӮиЎЁжүҖзӨәпјҡ
P(CO)/kPa
v/kPaвҖўs-1
P(NO2)/kPa
10
20
30
10
0.009
0.018
0.027
20
0.018
0.036
0.054
30
0.027
0.054
0.081
иӢҘеҸҚеә”еҲқе§Ӣж—¶p(CO)=p(NO2)akPaпјҢиҫҫеҲ°е№іиЎЎпјҢжөӢеҫ—дҪ“зі»дёӯp(NO)=bkPaпјҢеҲҷжӯӨж—¶v=kPaвҖўs-1(з”Ёеҗ«жңүaе’Ңbзҡ„д»Јж•°ејҸиЎЁзӨә)гҖӮ
-
пјҲ5пјү в…Ў.COгҖҒCO2еңЁзҺ°д»Је·ҘдёҡдёҠдҪңз”Ёи¶ҠжқҘи¶ҠжҳҺжҳҫгҖӮ
дёҖе®ҡжё©еәҰдёӢпјҢеҗ‘дёҖеӣәе®ҡдҪ“з§Ҝзҡ„еҜҶй—ӯе®№еҷЁдёӯе……е…ҘCOгҖҒCO2е’ҢH2жқҘеҲ¶еӨҮз”ІйҶҮгҖӮжөӢеҫ—еңЁдёҚеҗҢжё©еәҰдёӢзҡ„еҢ–еӯҰеҸҚеә”е№іиЎЎеёёж•°еҰӮиЎЁжүҖзӨәпјҡ
еҢ–еӯҰеҸҚеә”
е№іиЎЎеёёж•°
жё©еәҰ/в„ғ
500
700
800
в‘ 2H2(g)+CO(g)
 CH3OH(g)
CH3OH(g)K1
2.5
0.34
0.15
в‘ЎH2(g)+CO2(g)
 H2O(g)+CO(g)
H2O(g)+CO(g)K2
1.0
1.70
2.52
в‘ў3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)K3
еҸҚеә”в‘Ўдёӯзҡ„в–іH=0(еЎ«вҖңеӨ§дәҺвҖқжҲ–вҖңе°ҸдәҺвҖқ)пјҢK3=(з”ЁK1гҖҒK2иЎЁзӨә)
-
пјҲ6пјү з ”з©¶еҸҚеә”в‘ еңЁдёҚеҗҢжё©еәҰгҖҒеҺӢејәдёӢжҢүз…§зӣёеҗҢзҡ„зү©иҙЁзҡ„йҮҸжҠ•ж–ҷеҸҚеә”пјҢжөӢеҫ—COе№іиЎЎиҪ¬еҢ–зҺҮеҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ___(еЎ«ж ҮеҸ·)гҖӮ
 A . жё©еәҰпјҡT1>T2>T3 B . жӯЈеҸҚеә”йҖҹзҺҮпјҡv(a)>v(c)пјҢv(b)>v(d) C . е№іиЎЎеёёж•°пјҡK(a)>K(c)пјҢK(b)=K(d)
A . жё©еәҰпјҡT1>T2>T3 B . жӯЈеҸҚеә”йҖҹзҺҮпјҡv(a)>v(c)пјҢv(b)>v(d) C . е№іиЎЎеёёж•°пјҡK(a)>K(c)пјҢK(b)=K(d)
-
пјҲ1пјү е·ҘдёҡдёҠеёёе°Ҷеҗ«з ·еәҹжёЈ(дё»иҰҒжҲҗеҲҶдёәAs2S3)еҲ¶жҲҗжөҶзҠ¶пјҢйҖҡе…ҘO2ж°§еҢ–пјҢз”ҹжҲҗH3AsO4е’ҢеҚ•иҙЁзЎ«гҖӮеҶҷеҮәеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ
-
пјҲ2пјү е·ІзҹҘпјҡ

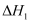

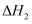


еҲҷеҸҚеә”
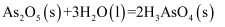 зҡ„
зҡ„  пјӣ
пјӣ -
пјҲ3пјү 298Kж—¶пјҢе°Ҷ
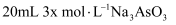 гҖҒ
гҖҒ 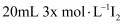 е’Ң20mL NaOHжә¶ж¶Іж··еҗҲпјҢеҸ‘з”ҹеҸҚеә”пјҡ
е’Ң20mL NaOHжә¶ж¶Іж··еҗҲпјҢеҸ‘з”ҹеҸҚеә”пјҡ 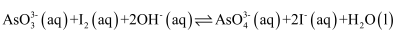 гҖӮжә¶ж¶Ідёӯ
гҖӮжә¶ж¶Ідёӯ  дёҺеҸҚеә”ж—¶й—ҙ(t)зҡ„е…ізі»еҰӮеӣҫжүҖзӨәгҖӮ
дёҺеҸҚеә”ж—¶й—ҙ(t)зҡ„е…ізі»еҰӮеӣҫжүҖзӨәгҖӮ 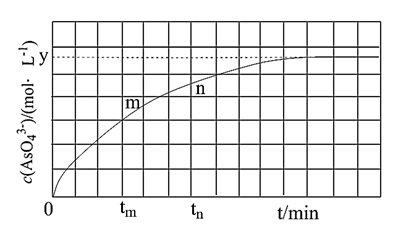
в‘ дёӢеҲ—дёҚеҸҜеҲӨж–ӯеҸҚеә”иҫҫеҲ°е№іиЎЎзҡ„жҳҜ(еЎ«ж ҮеҸ·)пјӣ
aпјҺжә¶ж¶Ізҡ„pHдёҚеҶҚеҸҳеҢ– bпјҺ

cпјҺ
 дёҚеҶҚеҸҳеҢ– dпјҺ
дёҚеҶҚеҸҳеҢ– dпјҺ 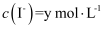
в‘Ўtnж—¶vйҖҶtmж—¶vйҖҶ(еЎ«вҖңпјһвҖқ гҖҒвҖңпјңвҖқжҲ–вҖң=вҖқ)пјӣ
в‘ўиӢҘе№іиЎЎж—¶жә¶ж¶Ізҡ„
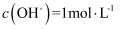 пјҢеҲҷиҜҘеҸҚеә”зҡ„еҢ–еӯҰе№іиЎЎеёёж•°K=гҖӮ(з”Ёеҗ«xгҖҒyзҡ„ејҸеӯҗиЎЁзӨә)пјӣ
пјҢеҲҷиҜҘеҸҚеә”зҡ„еҢ–еӯҰе№іиЎЎеёёж•°K=гҖӮ(з”Ёеҗ«xгҖҒyзҡ„ејҸеӯҗиЎЁзӨә)пјӣ -
пјҲ4пјү H3AsO3е’ҢH3AsO4ж°ҙжә¶ж¶Ідёӯеҗ«з ·зҡ„еҗ„зү©з§Қзҡ„еҲҶеёғеҲҶж•°(е№іиЎЎж—¶жҹҗзү©з§Қзҡ„жө“еәҰеҚ еҗ„зү©з§Қжө“еәҰд№Ӣе’Ңзҡ„еҲҶж•°)дёҺpHзҡ„е…ізі»еҲҶеҲ«еҰӮйўҳеӣҫ1е’Ңйўҳеӣҫ2жүҖзӨәпјҡ

в‘ д»Ҙй…ҡй…һдёәжҢҮзӨәеүӮ(еҸҳиүІиҢғеӣҙpHпјҡ8.0~10.0)пјҢе°ҶNaOHжә¶ж¶ІйҖҗж»ҙеҠ е…ҘеҲ°H3AsO3жә¶ж¶ІдёӯпјҢеҪ“жә¶ж¶Із”ұж— иүІеҸҳдёәжө…зәўиүІж—¶еҒңжӯўж»ҙеҠ гҖӮиҜҘиҝҮзЁӢдёӯдё»иҰҒеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјӣ
в‘ЎH3AsO4第дёҖжӯҘз”өзҰ»ж–№зЁӢејҸ
 зҡ„з”өзҰ»еёёж•°дёәKa1 пјҢ еҲҷpKa1=(
зҡ„з”өзҰ»еёёж•°дёәKa1 пјҢ еҲҷpKa1=(  )пјӣ
)пјӣ
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) в–іH=-1452 kJ/mol
H+(aq)+OH-(aq)=H2O(l) в–іH=-57.3 kJ/mol
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
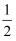 H2SO4(aq)+
H2SO4(aq)+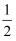 Ba(OH)2(aq)=
Ba(OH)2(aq)=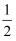 BaSO4(s)+H2O(l) в–іH=-57.3 kJ/mol
D . 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) в–іH=-131.4 kJ/mol
BaSO4(s)+H2O(l) в–іH=-57.3 kJ/mol
D . 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) в–іH=-131.4 kJ/mol
-
пјҲ1пјү 25в„ғгҖҒ101 kPaжқЎд»¶дёӢе……еҲҶзҮғзғ§8 gз”Ізғ·ж°”дҪ“з”ҹжҲҗдәҢж°§еҢ–зўіе’Ңж¶ІжҖҒж°ҙж—¶ж”ҫеҮәзғӯйҮҸдёә160 kJпјҢеҶҷеҮәиЎЁзӨәз”Ізғ·зҮғзғ§зғӯзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸгҖӮ
-
пјҲ2пјү е·ІзҹҘжӢҶејҖ1mol H-Hй”®гҖҒ1mol N-Hй”®гҖҒ1mol NвүЎNй”®йңҖиҰҒзҡ„иғҪйҮҸеҲҶеҲ«дёә436kJгҖҒ391kJе’Ң946kJпјҢеҲҷ
 дёҺ
дёҺ еҸҚеә”з”ҹжҲҗ
еҸҚеә”з”ҹжҲҗ зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
-
пјҲ3пјү е·ІзҹҘдёӢеҲ—зғӯеҢ–еӯҰж–№зЁӢејҸпјҡ
в‘ CH3COOH(l)пјӢ2O2(g)=2CO2(g)пјӢ2H2O(l) О”H1=-870 kJ/mol
в‘ЎC(s)пјӢO2(g)=CO2(g) О”H2=-393 kJ/mol
в‘ўH2(g)+
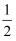 O2(g)=H2O(l) О”H3=-285 kJ/mol
O2(g)=H2O(l) О”H3=-285 kJ/molеҶҷеҮәз”ұC(s)гҖҒH2(g)е’ҢO2(g)еҢ–еҗҲз”ҹжҲҗCH3COOH(l)зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸгҖӮ
-
пјҲ4пјү е®һйӘҢе®Өз”Ё50mL 0.50molВ·L-1зӣҗй…ёдёҺ50mLжҹҗжө“еәҰзҡ„NaOHжә¶ж¶ІеңЁеҰӮеӣҫжүҖзӨәиЈ…зҪ®дёӯеҸҚеә”пјҢйҖҡиҝҮжөӢе®ҡж··еҗҲж¶Іжё©еәҰеҚҮй«ҳзҡ„жғ…еҶөи®Ўз®—дёӯе’ҢеҸҚеә”зҡ„еҸҚеә”зғӯгҖӮиҜҘиЈ…зҪ®зјәе°‘дёҖз§ҚзҺ»з’ғд»ӘеҷЁпјҢиҜҘд»ӘеҷЁзҡ„еҗҚз§°дёәпјӣе®һйӘҢе®ӨжҸҗдҫӣдәҶ0.50molВ·L-1е’Ң0.55molВ·L-1дёӨз§Қжө“еәҰзҡ„NaOHжә¶ж¶ІпјҢеә”йҖүжӢ©
 зҡ„жә¶ж¶ІиҝӣиЎҢе®һйӘҢгҖӮ
зҡ„жә¶ж¶ІиҝӣиЎҢе®һйӘҢгҖӮ
-
пјҲ1пјү е·ІзҹҘпјҡ2NO(g) +2CO(g)
 N2(g)+2CO2(g) в–іH =- 746.5kJВ·mol-1
N2(g)+2CO2(g) в–іH =- 746.5kJВ·mol-1N2(g) +O2(g)=2NO(g) в–іH=+180.5 kJВ·mol-1
2C(s)+ O2(g)=2CO(g ) в–іH=- 221 kJВ·mol-1
зўізҡ„зҮғзғ§зғӯ(в–іH)дёәгҖӮ
-
пјҲ2пјү е·ІзҹҘеңЁе®№з§Ҝдёә1 LеҲҡжҖ§е®№еҷЁдёӯиҝӣиЎҢеҸҚеә”пјҡ2NO2(g)
 N2O4(g)в–іH
N2O4(g)в–іHв‘ иҜҙжҳҺиҜҘеҸҚеә”е·ІиҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„жҳҜпјӣ
aпјҺ vжӯЈ(N2O4)= 2vйҖҶ(NO2) bпјҺдҪ“зі»йўңиүІдёҚеҸҳ
cпјҺж°”дҪ“еҜҶеәҰдёҚеҸҳ dпјҺ
 дёҚеҶҚеҸҳеҢ–
дёҚеҶҚеҸҳеҢ–в‘ЎжҠ•е…ҘNO2зҡ„зү©иҙЁзҡ„йҮҸеҲҶеҲ«дёәamolгҖҒbmolгҖҒcmolж—¶пјҢNO2е№іиЎЎиҪ¬еҢ–зҺҮйҡҸжё©еәҰеҸҳеҢ–зҡ„е…ізі»еҰӮдёӢеӣҫжүҖзӨәпјҡ

aгҖҒbгҖҒcзҡ„е…ізі»жҳҜпјӣв–іH 0пјҢе…¶зҗҶз”ұжҳҜпјӣ400 в„ғпјҢK=(еҲ—еҮәи®Ўз®—ејҸ)гҖӮ
-
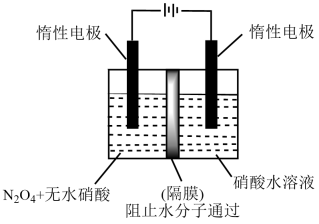
пјҲ3пјү дёӢеӣҫжүҖзӨәиЈ…зҪ®еҸҜз”ЁдәҺеҲ¶еӨҮN2O5 пјҢ йҖҡиҝҮйҡ”иҶңзҡ„зҰ»еӯҗжҳҜ пјҢ йҳіжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәгҖӮ
-
пјҲ1пјү жңүжңәзү©Mз»ҸиҝҮеӨӘйҳіе…үе…үз…§еҸҜиҪ¬еҢ–дёәNпјҢиҪ¬еҢ–иҝҮзЁӢдёәпјҡ


 в–іH=+88.6kJвҖўmol-1 пјҢ еҲҷMгҖҒNзӣёжҜ”пјҢиҫғзЁіе®ҡзҡ„жҳҜ(еЎ«вҖңMвҖқжҲ–вҖңNвҖқ)гҖӮ
в–іH=+88.6kJвҖўmol-1 пјҢ еҲҷMгҖҒNзӣёжҜ”пјҢиҫғзЁіе®ҡзҡ„жҳҜ(еЎ«вҖңMвҖқжҲ–вҖңNвҖқ)гҖӮ
-
пјҲ2пјү з”Ізғ·дёҺCO2еҸҜз”ЁдәҺеҗҲжҲҗеҗҲжҲҗж°”(дё»иҰҒжҲҗеҲҶжҳҜдёҖж°§еҢ–зўіе’Ңж°ўж°”)пјҢеҸ‘з”ҹзҡ„еҸҚеә”дёәпјҡCH4(g)+CO2(g)=2CO(g)+2H2(g)пјҢеҸҚеә”иҝҮзЁӢзҡ„иғҪйҮҸеҸҳеҢ–еҰӮеӣҫжүҖзӨәпјҢеҲҷиҜҘеҸҚеә”зҡ„в–іH=kJвҖўmol-1(з”Ёеҗ«E1гҖҒE2зҡ„д»Јж•°ејҸиЎЁзӨә)гҖӮ

-
пјҲ3пјү д№ҷзғҜжҳҜдё–з•ҢдёҠдә§йҮҸжңҖеӨ§зҡ„еҢ–еӯҰдә§е“Ғд№ӢдёҖпјҢеҸҜйҖҡиҝҮд№ҷзғ·зҡ„зғӯиЈӮи§Је’Ңж°§еҢ–иЈӮи§ЈеҲ¶еҸ–гҖӮиӢҘC-Cй”®гҖҒC=Cй”®гҖҒC-Hй”®е’ҢH-Hй”®зҡ„й”®иғҪеҲҶеҲ«дёәakJвҖўmol-1гҖҒbkJвҖўmol-1гҖҒckJвҖўmol-1е’ҢdkJвҖўmol-1 пјҢ еҸҚеә”C2H6(g)=CH4(g)+H2(g)в–іHпјҢеҲҷв–іH=kJвҖўmol-1(з”Ёеҗ«aгҖҒbгҖҒcгҖҒdзҡ„д»Јж•°ејҸиЎЁзӨә)гҖӮ
-
пјҲ4пјү еҲ©з”Ёз…ӨеҲ¶еҗҲжҲҗж°”пјҢеҶҚз”ұеҗҲжҲҗж°”й—ҙжҺҘеҲ¶д№ҷзғҜеҢ…еҗ«зҡ„еҸҚеә”жңүпјҡ
в‘ CO(g)+2H2(g)
 CH3OH(g)в–іH=akJвҖўmol-1
CH3OH(g)в–іH=akJвҖўmol-1в‘Ў2CH3OH(g)
 C2H4(g)+2H2O(g)в–іH=bkJвҖўmol-1
C2H4(g)+2H2O(g)в–іH=bkJвҖўmol-1еҲҷеҸҚеә”2CO(g)+4H2(g)
 C2H4(g)+2H2O(g)в–іH=kJвҖўmol-1(з”Ёеҗ«aгҖҒbзҡ„д»Јж•°ејҸиЎЁзӨә)гҖӮ
C2H4(g)+2H2O(g)в–іH=kJвҖўmol-1(з”Ёеҗ«aгҖҒbзҡ„д»Јж•°ејҸиЎЁзӨә)гҖӮ -
пјҲ5пјү з”ІйҶҮ(CH3OH)еұһдәҺеҸҜеҶҚз”ҹиө„жәҗпјҢиғҪеӨҹд»ЈжӣҝжұҪжІ№дҪңдёәжұҪиҪҰзҡ„зҮғж–ҷгҖӮеёёжё©дёӢпјҢе®һйӘҢжөӢеҫ—1gз”ІйҶҮе®Ңе…ЁзҮғзғ§з”ҹжҲҗдәҢж°§еҢ–зўіж°”дҪ“е’Ңж¶ІжҖҒж°ҙж—¶ж”ҫеҮә22.7kJзҡ„зғӯйҮҸпјҢиҜ•еҶҷеҮәиЎЁзӨәз”ІйҶҮзҮғзғ§зғӯзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸгҖӮ
-
пјҲ6пјү е·ІзҹҘCOе’Ңдёҷзғ·зҡ„зҮғзғ§зғӯеҲҶеҲ«дёә283kJвҖўmol-1е’Ң2220kJвҖўmol-1гҖӮзҺ°жңүCOе’ҢC3H8зҡ„ж··еҗҲж°”дҪ“е…ұ3molпјҢе®Ңе…ЁзҮғзғ§ж—¶ж”ҫеҮә2786kJзҡ„зғӯйҮҸпјҢеҲҷеңЁж··еҗҲж°”дҪ“дёӯCOе’ҢC3H8зҡ„дҪ“з§ҜжҜ”жҳҜгҖӮ



