阿伏加德罗常数 知识点题库
N、n、NA之间关系
设NA为阿伏加德罗常数的值.下列说法中,正确的是( )
A . 标准状况下,22.4L的NO2和CO2混合气体中含有的氧原子数为4NA
B . 密闭容器中,46gNO2和N2O4的混合气体所含分子个数为NA
C . 常温常压下,22.4L的液态水含有2.24×10﹣8NA个OH﹣
D . 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
下列说法正确的是( )
A . 7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023
B . 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023
C . 2.24LSO2与O2混合气体中所含氧原子数为0.2×6.02×1023
D . VLamol•L﹣1的氯化铁溶液中,若Fe3+的数目为6.02×1023 , 则Cl﹣的数目大于3×6.02×1023
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A . 80mL 10mol/L的浓盐酸与足量的MnO2加热反应,产生Cl2分子数为0.2NA
B . 25g质量分数为68%的H2O2水溶液中含氧原子数目为NA
C . 1L 1mol/L的Fe2(SO4)3溶液中含有的SO42﹣离子数为3NA
D . 常温常压下,等质量的CO和N2中含有的原子数目均为2NA
下列说法正确的是( )
A . 22.4L氧气中一定含有6.02×1023个氧分子
B . 18g水在标准状况下的体积是22.4L
C . 标准状况下,20mL NH3与60mL O2所含的分子数之比为1:3
D . 物质的摩尔质量在数值上等于其相对分子质量或相对分子质量
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A . 标准状况下,22.4 LCCl4含有的分子数为NA个
B . 500mL 1moL/L的盐酸溶液中含有的HCl分子数为0.5 NA个
C . 将1L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA个
D . 23gNa与O2反应生成Na2O和Na2O2的混合物,转移的电子数为 NA个
设  表示阿伏加德罗常数的数值,下列叙述中正确的是( )
表示阿伏加德罗常数的数值,下列叙述中正确的是( )
 表示阿伏加德罗常数的数值,下列叙述中正确的是( )
表示阿伏加德罗常数的数值,下列叙述中正确的是( )
A . 0.1 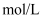
 溶液中Na+的数目为0.2
溶液中Na+的数目为0.2  B . 标准状况下,18 g 的
B . 标准状况下,18 g 的  中含有的电子数为10
中含有的电子数为10  C . 标准状况下,11.2L的
C . 标准状况下,11.2L的  中所含的分子数为0.5
中所含的分子数为0.5  D . 2.4g 金属镁变为镁离子失去的电子数为0.1
D . 2.4g 金属镁变为镁离子失去的电子数为0.1 
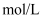
 溶液中Na+的数目为0.2
溶液中Na+的数目为0.2  B . 标准状况下,18 g 的
B . 标准状况下,18 g 的  中含有的电子数为10
中含有的电子数为10  C . 标准状况下,11.2L的
C . 标准状况下,11.2L的  中所含的分子数为0.5
中所含的分子数为0.5  D . 2.4g 金属镁变为镁离子失去的电子数为0.1
D . 2.4g 金属镁变为镁离子失去的电子数为0.1 
设NA为阿伏加德罗常数的数值,下列说法中错误的是( )
A . 4.6g金属钠变成Na+ , 失去的电子数为0.2NA
B . 1.0L 1mol/L NaOH水溶液中含有的氧原子数为NA
C . 17g NH3 所含的电子数为10NA
D . 9.5g MgCl2 溶于水所得溶液中含Cl- 数为0.2NA
已知NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 常温下2.2gCO2中含有共用电子对的数目为2NA
B . 标准状况下,11.2L苯中含的碳原子数为3NA
C . 25℃时,0.1mol/L的一元强酸HA中,H+的个数为0.1NA
D . 6.4gCu与一定浓度的HNO3完全反应得到混合气体,则反应转移的电子数为0.2NA
设NA为阿伏加德罗常数值,下列说法错误的是( )
A . 常温常压下,32gO2和32gO3所含氧原子数都是2NA
B . 同温、同压下,相同体积的氟气和氩气所含的原子数相等
C . 18g D2O含有的电子数为9NA
D . 2.4g金属镁变成镁离子时失去的电子数目为0.2NA
设NA表示阿伏加德罗常数,下列说法正确的是( )
A . 将1L0.1mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为0.1NA
B . 常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子
C . 1L0.1mol/L Na2SO4溶液中含有0.4NA个氧原子
D . 在标准状况下,22.4L的CCl4所含的分子数为NA
NA为阿伏加德罗常数,下列说法正确的是( )
A . 7.8g苯所含碳碳双键数目为0.3NA
B . 28g乙烯所含共用电子对数目为5NA
C . 标准状况下,11.2L乙醇所含分子数为0.5NA
D . 16g甲烷电子数为10NA
1个某种氯原子的质量是a g,1个12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①该氯原子的相对原子质量为12a/b ②m g该氯原子的物质的量为m/(aNA) mol ③该氯原子的摩尔质量是aNA g ④a g该氯原子所含的电子数为17 mol
A . ①②
B . ①③
C . ②③
D . ②④
NA为阿伏加德罗常数的值,下列有关说法错误的是( )
A . 常温常压下,16gO2与O3混合气体中含有NA个氧原子
B . 1L0.1mol• L-1CH3COOH溶液中所含离子总数约为0.2 NA
C . 含0.2molH2SO4的浓硫酸与足量铜反应生成SO2分子数小于0.1NA
D . 1 molFeBr2与足量Cl2反应,转移电子数为3NA
用 NA 表示阿伏加德罗常数的值,下列叙述错误的是( )
A . 12 g 金刚石中含有的共价键数为 2NA
B . 14 g 乙烯和丁烯的混合物中含有的原子总数为 3NA
C . 标准状况下,22.4 L 乙醇含有的氧原子数目为 NA
D . 乙醇催化氧化生成 1mol 乙醛转移的电子数为 2NA
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A . 2.24L(标准状况)CCl4中含有的碳原子数为0.1NA
B . 4.6g乙醇中含有C—H键的数目为0.6NA
C . 标准状况下,11.2L由甲烷和乙烯组成的混合物中含氢原子的数目为2NA
D . 1mol乙酸与足量的乙醇发生酯化反应,生成的乙酸乙酯的分子数为NA
-
(1) I.食品包装袋中有一个小纸袋,上面写着“石灰干燥剂”。
“石灰干燥剂”的主要成分生石灰是(填化学式),“生石灰”所属的物质类型是(填序号)。
①金属氧化物;②碱性氧化物:③碱;④盐:⑤化合物
-
(2) 生石灰可做干燥剂的理由是(用化学方程式表示)。
-
(3) II.在明代宋应星所著的《天工开物)中,有关于火法炼锌的工艺记载:“山中炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。冷定毁罐取出。……即倭铅也。……以其似铅而性猛,故名之曰‘倭’云。”(注炉甘石的主要成分是碳酸锌。)反应原理:ZnCO3+2C
 Zn+3CO↑
Zn+3CO↑ 请根据原料的来源推测碳酸锌在水中溶解性: (“易溶”或“难溶”)
-
(4) 在该反应中,氧化剂是(填化学式,下同),还原产物是。
-
(5) 若反应中有0.2mol电子发生转移,则生成CO气体的分子数为:。
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A . 标准状况下,22.4 L H2O含有的分子数为NA
B . 2.3 g Na与足量水反应转移电子数为0.1NA
C . 1 L 1 mol·L-1 C2H5OH水溶液中含有的氢原子数为6NA
D . 22.4 L Cl2中含有Cl-Cl键的数目一定为NA
用 表示阿伏加德罗常数的值,下列叙述中正确的是( )
表示阿伏加德罗常数的值,下列叙述中正确的是( )
 表示阿伏加德罗常数的值,下列叙述中正确的是( )
表示阿伏加德罗常数的值,下列叙述中正确的是( )
A . 常温常压下,28gCO和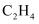 混合气体中的碳原子数为
混合气体中的碳原子数为 B . 标准状况下,11.2L的乙醇所含的氢原子数等于3
B . 标准状况下,11.2L的乙醇所含的氢原子数等于3 C .
C .  与足量水反应转移的电子数为0.1
与足量水反应转移的电子数为0.1 D .
D .  溶液中含有
溶液中含有 的数目为0.1
的数目为0.1
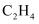 混合气体中的碳原子数为
混合气体中的碳原子数为 B . 标准状况下,11.2L的乙醇所含的氢原子数等于3
B . 标准状况下,11.2L的乙醇所含的氢原子数等于3 C .
C .  与足量水反应转移的电子数为0.1
与足量水反应转移的电子数为0.1 D .
D .  溶液中含有
溶液中含有 的数目为0.1
的数目为0.1
设 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A . 在含4molSi-O键的二氧化硅晶体中,氧原子的数目为 B .
B .  溶液中含有的氧原子数目为
溶液中含有的氧原子数目为 C . 含4.6g钠元素的
C . 含4.6g钠元素的 和
和 的混合物中含有阴离子总数为
的混合物中含有阴离子总数为 D . 由
D . 由 与
与 组成的4.0g物质中含中子数为
组成的4.0g物质中含中子数为
 B .
B .  溶液中含有的氧原子数目为
溶液中含有的氧原子数目为 C . 含4.6g钠元素的
C . 含4.6g钠元素的 和
和 的混合物中含有阴离子总数为
的混合物中含有阴离子总数为 D . 由
D . 由 与
与 组成的4.0g物质中含中子数为
组成的4.0g物质中含中子数为
最近更新



