铁的氧化物和氢氧化物 知识点
氧化铁Fe2O3,一般性状:红棕色粉末,别名:三氧化二铁、铁红(铁锈主要成分)、铁丹。
四氧化三铁Fe3O4,别名:磁性氧化铁、氧化铁黑、磁铁、磁石、吸铁石,一般性状:具有磁性的黑色晶体。
铁的氢氧化物:氢氧化亚铁Fe(OH)2,白色固体,难溶性水,易被氧化成氢氧化铁。
氢氧化铁Fe(OH)3,红褐色固体,难溶性水。
铁的氧化物和氢氧化物 知识点题库
①Al2O3  NaAlO2(aq)
NaAlO2(aq)  Al(OH)3
Al(OH)3
②S  SO3
SO3  H2SO4
H2SO4
③饱和NaCl(aq)  NaHCO3
NaHCO3  Na2CO3
Na2CO3
④Fe2O3  FeCl3(aq)
FeCl3(aq)  无水FeCl3
无水FeCl3
⑤MgCl2(aq)  Mg(OH)2
Mg(OH)2  MgO.
MgO.
-
(1) 利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3•5H2O]的实验流程如图所示:
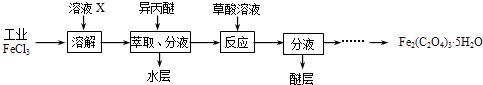
①为抑制FeCl3水解,溶液X为.
②上述流程中FeCl3能被异丙醚萃取,其原因是;检验萃取、分液后所得水层中是否含有Fe3+的方法是.
③所得Fe2(C2O4)3•5H2O需用冰水洗涤,其目的是.
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4 , KMnO4标准溶液应置于右图所示仪器(填“甲”或“乙”)中.下列情况会造成实验测得Fe2(C2O4)3•5H2O含量偏低的是.
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
-
(2) 某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3 , 再由FeCl3合成Fe2(C2O4)3•5H2O.请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;;调节溶液pH,将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3•6H2O;,得到无水FeCl3 .
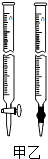
物质 编号 | a | b | c |
① | Al2O3 | NaAlO2 | Al(OH)3 |
② | FeO | Fe(NO3)2 | Fe(OH)2 |
③ | MgCl2 | Mg(OH)2 | MgO |
④ | CuO | CuSO4 | Cu(OH)2 |
⑤ | Si | SiO2 | H2SiO3 |
⑥ | C | CO | CO2 |
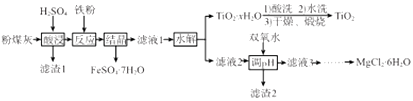
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34 , Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Mg(OH)2]=1.0×10-11
请回答下列问题:
-
(1) “酸浸”时TiO2发生反应的离子方程式为。
-
(2) “反应”时加入铁粉的作用为。
-
(3) “结晶”需控制在70℃左右,温度过高会导致的后果为。
-
(4) “水解”反应的离子方程式为。所得TiO2•xH2O 沉淀进行酸洗的目的为。
-
(5) 为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”最小为。
-
(6) 实验室用MgCl2溶液制备MgCl2•6H2O,需进行的操作为、降温结晶、过滤、洗涤、干燥。
-
(7) FeSO4•7H2O样品纯度的测定:取a g样品溶于水配成bmL.溶液;用酸化的cmol/LKMnO4标准溶液滴定,达到滴定终点时消耗标准液的体积为dmL,样品中FeSO4•7H2O的质量分数为 (用代数式表示)。
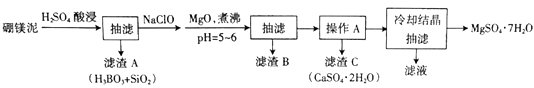
已知部分金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2,Fe(OH)2:9.7,Mg(OH)2:11.2。
-
(1) 为提高酸浸时浸出速率,可采取的措施有(写出两条)。
-
(2) H2SO4 和Na2B4O7发生反应的化学方程式为。
-
(3) 加入NaClO后可以生成一种不溶于水的黑色固体,则反应的离子方程式为。
-
(4) 加MgO煮沸,并调整溶液pH=5~6 的目的是。
-
(5) 已知MgSO4、CaSO4的溶解度如下表:
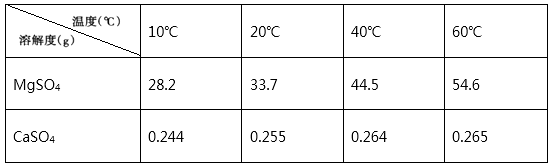
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4。除去,根据上表数据,步骤为,。
-
(6) 本实验中多次用到抽滤操作,其装置如图,相比普通过滤,抽滤的优点是。

-
(7) 实验中提供的硼镁泥共100 g,得到MgSO4·7H2O为172.2 g,则MgSO4·7H2O 的产率为。
①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用
②纯铁比生铁抗腐蚀性更强
③单质铝在空气中比较耐腐蚀,所以铝是不活泼金属
④向紫色石蕊试液中加入过量的Na2O2粉末,振荡,溶液变为蓝色并有气泡产生
⑤青铜、不锈钢、硬铝都是合金
⑥可通过焰色反应区分钾元素和钠元素
⑦将FeCl3溶液滴入KI-淀粉溶液中,溶液变蓝色
⑧铝粉和氧化镁粉末混合,高温能发生铝热反应
 NO2
B . Fe(OH)2
NO2
B . Fe(OH)2  Fe(OH)3
C . S
Fe(OH)3
C . S  SO3
D . Al2O3
SO3
D . Al2O3  Al(OH)3
Al(OH)3
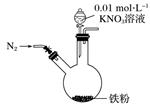
|
实验步骤 |
实验现象 |
|
①打开弹簧夹,缓慢通入N2 |
|
|
②加入0.01 mol·L-1的酸性KNO3溶液100 mL |
铁粉部分溶解,溶液呈浅绿色;铁粉不再溶解后,剩余铁粉表面附着少量白色物质 |
|
③反应停止后,拔掉橡胶塞,将圆底烧瓶取下 |
烧瓶内气体的颜色没有发生变化 |
|
④将剩余固体过滤 |
表面的白色物质变为红褐色 |
-
(1) 通入N2并保持后续反应均在N2氛围中进行的实验目的是。
-
(2) 白色物质是(写化学式)。
-
(3) 为了探究滤液的成分,该同学进一步设计了下述实验:
实验步骤
实验现象
①取部分滤液于试管中,向其中加入KSCN溶液
溶液无变化
②将上述溶液分为两份,一份中滴入氯水,另一份中滴加稀硫酸
两份溶液均变为红色
③另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸
有气体生成,该气体使湿润的红色石蕊试纸变蓝
(ⅰ)根据以上实验现象,可以判断滤液中存在 (填离子符号)。
(ⅱ)步骤②中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因:(写第一步反应)。
(ⅲ)步骤③中生成气体的离子方程式为。
-
(1) ①写出漂白粉有效成分的化学式。
②写出1,2-二溴乙烷的结构简式。
-
(2) 写出四氧化三铁与稀盐酸反应的化学方程式。
-
(1) 酸浸:用硫酸溶液浸取烧渣中的铁元素。若其他条件不变,下列措施中能提高单位时间内铁元素浸出率的有____(填序号)。A . 适当升高温度 B . 适当加快搅拌速率 C . 适当减小硫酸浓度
-
(2) 沉铁:取10mL“酸浸”后的滤液并加入9gNH4HCO3 , 改变氨水用量,测得铁的沉淀率随氨水用量的变化如图。
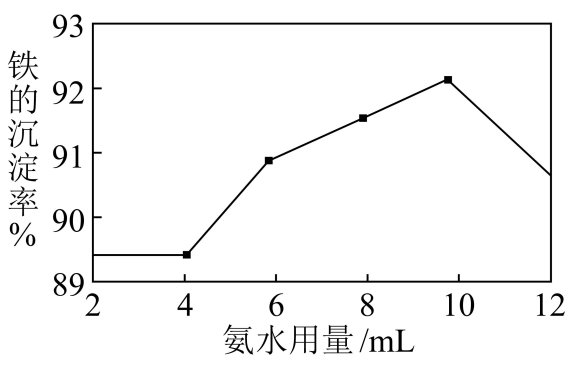
①为提高铁的沉淀率,应控制氨水用量为。②氨水用量小于4mL时,铁的沉淀率几乎无变化,其原因可能为。
-
(3) 过滤:“沉铁”后过滤,滤渣中含有FeOOH和FeCO3 , 滤液中浓度最大的阳离子是(填化学式)。
-
(4) 焙烧:FeOOH和FeCO3高温焙烧后均可得到铁红,写出FeCO3高温焙烧的化学方程式。



