碱金属及其化合物的性质实验 知识点题库
(1)KO2与CO2反应的化学方程式是 .
(2)等质量的KO2和Na2O2分别与足量的CO2反应,生成O2的质量比是 .对比KO2和Na2O2 , 更适合的补氧剂是 .
-
(1) 将锂在纯氮气中燃烧可制得Li3N,其反应的化学方程为 .
-
(2) 氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2
 LiNH2+2LiH,氧化产物为 (填化学式).在270℃时,该反应可逆向发生放出H2 , 因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1).
LiNH2+2LiH,氧化产物为 (填化学式).在270℃时,该反应可逆向发生放出H2 , 因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1).
-
(3) 将Li2CO3、FeC2O4•2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4 , 写出反应的化学方程式 ,制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是 .
-
(4) 将一定浓度磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出LiFePO4沉淀,阳极的电极反应式为 .
-
(5) 磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li1﹣xFePO4之间的转化,电池放电时负极发生的反应为
LixC6﹣xe﹣═xLi++6C,写出电池放电时反应的化学方程式 .
-
(1)
与氧气反应差异性:(将横线补充完整)
Li+O2
 ( 色、氧化锂);
( 色、氧化锂);Na+O2
 ( 色、过氧化钠);
( 色、过氧化钠);K+O2
 ( 色,);
( 色,);Rb+ O2
 (棕色、);
(棕色、);CS+ O2
 ( 色、 ).
( 色、 ). -
(2) 与水反应差异性:(填反应现象)
2Li+2H2O=2LiOH+H2↑( );
2Na+2H2O=2NaOH+H2↑(剧烈);
2K+2H2O=2KOH+H2↑( );
2Rb+2H2O=2RbOH+H2↑(更猛烈、燃烧、爆炸).
-
(3) 写出下列反应的化学方程式:
过氧化钾与CO2: ;
超氧化钾与水、CO2: 、 ;
氧化锂与水、CO2: 、 .
(1)切开的金属钠暴露在空气中,开始时可以观察到的现象是 ,所发生反应的化学方程式是 .
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是① ,② .将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是 (填序号).
A.有气体生成 B.钠熔化成小球并在液面上游动
C.溶液底部有银白色的金属钙生成 D.溶液变浑浊
(3)钠与水反应的离子方程式为 .在反应过程中,若生成标准状况下224mL的H2 , 则转移的电子的物质的量为 .
(4)根据上述实验过程中钠所发生的有关变化,试说明将金属钠保存在煤油中的目的是 .
某学生为探究钠与CO2的反应,利用如下装置进行实验.(已知PdCl2能被CO还原得到黑色的Pd).可供选择的药品有:CaCO3(块状)、Na2CO3(粉末)、盐酸、稀硫酸、钠.
(1)请将图中各装置连接完整:②→ → →①→ .(填装置序号)
(2)写出装置②中反应的离子方程式: .
(3)检查装置气密性并装好药品后,当观察到 现象时再点燃酒精灯;装置④的作用是 .
(4)已知CO在潮湿环境中可将PdCl2还原为黑色粉末状的钯(Pd),写出该反应的化学方程式 .
(5)实验过程中CO2足量,装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中反应后固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体.据此现象写出Na与CO2反应的化学方程式: .

Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
[实验步骤]
Ⅰ.按如图所示装置(部分仪器未画出)组装仪器,并检查装置气密性.

Ⅱ.将0.6g炭粉与3.9g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成).
Ⅲ.用酒精灯微微加热试管底部.
[实验现象]
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊.
请回答:
(1)装置B的作用是 .
(2)通过探究发现,装置A中只发生反应2Na2O2+C Na2CO3+X,则X为 (填化学式).
Na2CO3+X,则X为 (填化学式).
①请设计实验证明产物X的存在,简要写出操作方法、现象和结论: .
②有人认为炭粉的加入量的多少会影响产物X的检验,请简要说明原因: .
(3)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd:Mr=106),同时生成另外两种新物质.已知反应过程中转移6.02×1023个电子时,生成53g Pd,该反应的化学方程式为 .
(4)将装置A中完全反应后所得物质溶于适量水,配成溶液,回答下列问题:
①溶液中下列关系正确的是 (填字母序号).
a.c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)
b.c(Na+)>c(OH﹣)>c(CO32﹣)>c(HCO3﹣)
c.c(Na+)=2[c(CO32﹣)+c(HCO3﹣)+c(H2CO3)]
d.c(H+)+c(Na+)=c(OH﹣)+2c(CO32﹣)+c(HCO3﹣)
②若使所得溶液与100mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为 .
有两个实验小组探究Na2O2与SO2的反应,都用如图所示装置进行实验.
(1)第1小组认为Na2O2与SO2反应生成Na2SO3和O2 . 判断有无O2生成的方法:把 放在试管C口处观察现象即可判断有无Na2SO3生成的方法:取B中反应后的固体溶于 ,发现有气体生成,再把气体通入品红溶液中,若品红褪色,说明 (填“有”或“无”)Na2SO3生成.
(2)第2小组认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成,他们设计如下方案(假设B中已无Na2O2)

以上方案是否合理? (填“是”或“否”),原因是 .

某同学在实验室从如图I标签的试剂瓶中取少许钠进行燃烧实验,实验后发现还有少许黑色固体生成.从反应物及实验操作猜测:该黑色物质可能为炭与另一种氧化物组成的混合物.

根据题意和图示回答下面问题:
(1)装置图Ⅱ中A的名称
(2)此氧化物可能是 或 (写化学式)
(3)对黑色固体物质的组成作如图所示探究
①实验I加入盐酸溶液的目的是 ;
②仅通过实验Ⅱ,用最简步骤能快速确定
黑色氧化物的组成,请完善该设计.(限选试剂:稀盐酸、KSCN溶液、10%H2O2 溶液)
实验操作 | 预期现象与结论 | 相关离子方程式 |
取少量实验Ⅰ中的澄清溶液,加入试剂 . | . | . |
-
(1) 写出Na2O2与水反应的化学方程式.
-
(2) 试设计实验证明溶液X中含过氧化氢.
-
(3) 通过上述实验证明溶液中确实存在H2O2 . 取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式: H2O2+Fe2++OH﹣﹣﹣ Fe(OH)3↓,该反应中H2O2表现了性(填“氧化”或“还原”).
-
(4) 已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了性(填“氧化”或“还原”).

下列叙述正确的是( )
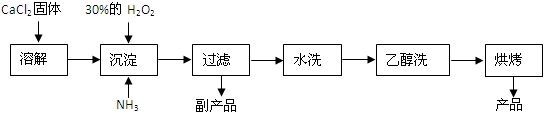
已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
-
(1) 用上述方法制取CaO2·8H2O的化学方程式是。
-
(2) 检验“水洗”操作滤液中是否含Cl- , 的正确操作是。
-
(3) 沉淀时常用冰水控制温度在0℃左右有利于提高CaO2·8H2O产率,其可能原因是(写出两种)①;②。
-
(4) 测定产品中CaO2含量的实验步骤:
第一步:准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,
再滴入少量2mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液
VmL。(已知:I2+2S2O32-=2I-+S4O62-)
①CaO2的质量分数为(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不变”、“偏低”或“偏高”),原因是。
 , 则金属锂在空气燃烧生成
, 则金属锂在空气燃烧生成 C .
C .  通入
通入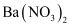 溶液中至过量,没有明显现象,则
溶液中至过量,没有明显现象,则 通入
通入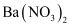 溶液中至过量,也没明显现象
D . 1
溶液中至过量,也没明显现象
D . 1 乙醛和足量的银氨溶液反应可得2
乙醛和足量的银氨溶液反应可得2 金属银,则1
金属银,则1 甲醛和足量的银氨溶液反应也可得2
甲醛和足量的银氨溶液反应也可得2 银
银



