元素周期表的结构及其应用 知识点题库
下列说法正确的是( )
A . 碱金属的单质中,锂的还原性最强
B . 第IA族元素比第IIA族元素的金属性强
C . 同周期中,原子半径随原子序数的增大而减小(稀有气体除外)
D . 随着核电荷数的递增,第三周期元素的氧化物对应的水化物的酸性逐渐增强
下列各组元素中,按最高正价递增顺序排列的是( )
A . C,N,O,F
B . Li、Na、K,Rb
C . F,Cl、Br、I
D . K,Mg、C,S
A、B、C、D、E代表5种元素.请填空:
-
(1) A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为.
-
(2) B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素的基态原子的电子排布式为,C的元素符号为.
-
(3) D元素的正三价离子的3d亚层为半充满,D的元素符号为,其基态原子的电子排布式为.
-
(4) E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为,其基态原子的电子排布式为.
-
(5) 前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有种.
下列关于元素周期表的叙述中正确的是( )
A . 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B . 元素周期表共七个横行代表七个周期,18 个纵横代表18 个族
C . 主、副族元素的族序数从左到右都是依次由小到大排列(如ⅠB→→ⅦB)
D . 除零族外,由长、短周期元素共同组成的元素族称为主族
橄榄石型LiFePO4是以中国锂离子电池正极材料,下列有关LiFePO4的说法中不正确的是( )
A . LiFePO4中铁元素的化合价为+2价
B . LiFePO4中Li、P、O均属于短周期元素
C . 能与稀硝酸发生氧化还原反应
D . LiFePO4中Li、Fe、P均属于主族元素
已知某元素的最高化合价为+7价,下列说法中正确的是( )
A . 该元素在元素周期表中一定处于ⅦA族
B . 该元素可能是氟元素
C . 该元素的某种化合物可能具有漂白性
D . 该元素的单质没有还原性
短周期主族元素X、Y、Z、W原子序数依次增大,X的原子半径小于Y的原子半径,Z的单质是空气中含量最高的气体,W原子最外层比Y原子最外层少1个电子,W的单质制得的金属容器常温下可盛装浓硫酸。下列说法正确的是( )
A . 原子半径:r(Y)<r(Z)<r(W)
B . X、Y形成的化合物只含有极性键
C . Z、W的简单离子具有相同的电子层结构
D . Y的最高价氧化物的水化物酸性比Z的强
A,B,C,D,E五种短周期元素的原子序数逐渐增大。A是原子半径最小的元素,B可形成多种同素异形体,其中一种的硬度是自然界中最大的。D元素原子的最外层电子数是次外层电子数的3倍。E元素的M层电子数等于A和B的质子数之和。
-
(1) 写出元素D在元素周期表中的位置:。
-
(2) B,C,D三种元素的最简单氢化物的稳定性由强到弱的顺序是(填化学式)。
-
(3) A,B,C,D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间发生反应的一个离子方程式:。
-
(4) ED2是一种具有强氧化性的新型消毒剂,一定条件下4mol ED2与5 mol C2A4恰好完全反应,请写出反应的化学方程式:;若反应消耗1 mol C2A4 , 则转移电子的物质的量为。
位于3个不同短周期的主族元素a、b、c、d、e,原子序数依次增大,其中b、d同主族,d元素最高化合价与最低化合价代数和等于4,c原子最外层电子数比b原子次外层电子数多1,回答下列问题。
-
(1) 写出a的元素符号,b在周期表中的位置是第周期族;
-
(2) a与e形成的是(填“离子”或“共价”)化合物;
-
(3) 上述五种元素中,非金属性最强的是(填元素名称);
-
(4) d元素最高价氧化物对应水化物的化学式是,d和e的气态氢化物稳定性强的是(填化学式);
-
(5) 元素c的原子结构示意图为;c的单质与a的同主族第3周期元素最高价氧化物对应水化物反应的离子方程式为。
下列关于新型净水剂高铁酸钾(K2FeO4)有关说法错误的是()
A . Fe位于元素周期表第四周期,VⅢA族
B . K在同周期中,原子半径最大,金属性最强
C . 高铁酸钾具有强氧化性
D . 高铁酸钾中Fe的化合价为+6
在元素周期表中金属与非金属的分界处,可以找到( )
A . 合金
B . 农药
C . 催化剂
D . 半导体材料
下表为元素周期表的短周期区域一部分,回答下列问题:
|
① |
② |
③ |
||||
|
④ |
⑤ |
-
(1) ⑤的简单离子结构示意图为
 ,此元素在周期表中的位置为,同主族元素中,非金属性强于此元素的有(填元素符号)。
,此元素在周期表中的位置为,同主族元素中,非金属性强于此元素的有(填元素符号)。
-
(2) ④与⑤组成的化合物常用于食品调味,用电子式表示此化合物的形成过程。
-
(3) ②、③、④元素的简单离子半径由大到小的顺序为(填离子符号)。
-
(4) 由③、④组成的化合物中可能含有化学键的类型为。
-
(5) ②与③的简单氢化物稳定性更强的是(填化学式)。
-
(6) 设计实验证明②的非金属性强于①:。
短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,Y组成的单质是一种良好的半导体材料,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示.下列叙述正确的是( )

A .  是共价化合物
B . 简单气态氢化物的稳定性:Y>Z
C . Y的最高价氧化物的水化物是一种弱酸
D . W、X、Z的简单离子半径依次增大
是共价化合物
B . 简单气态氢化物的稳定性:Y>Z
C . Y的最高价氧化物的水化物是一种弱酸
D . W、X、Z的简单离子半径依次增大
 是共价化合物
B . 简单气态氢化物的稳定性:Y>Z
C . Y的最高价氧化物的水化物是一种弱酸
D . W、X、Z的简单离子半径依次增大
是共价化合物
B . 简单气态氢化物的稳定性:Y>Z
C . Y的最高价氧化物的水化物是一种弱酸
D . W、X、Z的简单离子半径依次增大
X、Y、Z、W是原子序数依次增大的短周期元素,其中X的某种同位素不含中子,X与Y可形成最简单的有机物,Z的简单氢化物溶于水呈碱性,W原子的电子层数与最外层电子数相等。下列说法错误的是( )
A . X和Y可形成多种化合物
B . W的氧化物可用作耐火材料
C . 分离液态空气可得Z的单质
D . Y的氧化物均为酸性氧化物
在我国北斗三号全球卫星导航系统中使用了“铷( )原子钟”,它被誉为卫星的“心脏”,下列有关说法错误的是( )
)原子钟”,它被誉为卫星的“心脏”,下列有关说法错误的是( )
 )原子钟”,它被誉为卫星的“心脏”,下列有关说法错误的是( )
)原子钟”,它被誉为卫星的“心脏”,下列有关说法错误的是( )
A . 铷元素位于第五周期第IA族
B .  和
和 具有相同的电子数
C .
具有相同的电子数
C .  的中子数为48
D .
的中子数为48
D .  和
和 互为同素异形体
互为同素异形体
 和
和 具有相同的电子数
C .
具有相同的电子数
C .  的中子数为48
D .
的中子数为48
D .  和
和 互为同素异形体
互为同素异形体
硒(Se)被誉为“生命的奇效元素”。富硒食品倍受追捧。已知硒元素与氧元素同族。与钙元素同周期。下列关于硒的描述不正确的是( )
A . 原子序数是24
B . 气态氢化物化学式是H2Se,还原性比HCl强
C . 最高价氧化物是SeO3 , 是酸性氧化物
D . 原子半径比硫原子的原子半径大
元素的性质与元素原子最外层电子数密切相关。下列说法正确的是( )
A . 金属元素原子最外层电子数均小于4,较易失去电了形成阳离子
B . 碱金属元素原子最外层电子数均为1,易失电子,其单质常做还原剂
C . 卤族元素原子最外层电子数均为7,易得电子,最高化合价均为 D . 0族元素原子最外层电子数均为8,既不容易获得电子,也不容易失去电子
D . 0族元素原子最外层电子数均为8,既不容易获得电子,也不容易失去电子
 D . 0族元素原子最外层电子数均为8,既不容易获得电子,也不容易失去电子
D . 0族元素原子最外层电子数均为8,既不容易获得电子,也不容易失去电子
下表为元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
|
| IA | 0 | ||||||
| 1 | IIA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ⑦ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑥ | ⑨ | |||
| 4 | ② | ④ |
-
(1) ①~⑩中,最活泼的金属元素是(写元素符号)。
-
(2) ①⑦⑧的简单离子,其半径最大的是(写离子符号)。
-
(3) ⑥⑧⑨的气态氢化物,热稳定性高低顺序是(填化学式)。
-
(4) 元素的非金属性:⑥⑦(填“>”或“<”)。
-
(5) ①~⑨的最高价氧化物的水化物中:酸性最强的是(填化学式)。
X、Y、Z、M、W是五种短周期主族元素,其原子半径与原子序数的关系如图甲所示,X、Y、Z、M形成的化合物如图乙所示,Z与W同主族。下列说法错误的是( )

A . 简单氢化物的熔沸点:Z>W
B . 简单离子的半径:W>Z>M
C . X2Z2和M2Z2中的化学键类型完全相同
D . 最高价氧化物对应水化物的酸性:W>Y
醇的Jones氧化:用丙酮作溶剂,一级醇(或二级醇)与铬酸( )作用可氧化生成羧酸(或酮)的反应,反应过程如下图所示。下列说法错误的是( )
)作用可氧化生成羧酸(或酮)的反应,反应过程如下图所示。下列说法错误的是( )
 )作用可氧化生成羧酸(或酮)的反应,反应过程如下图所示。下列说法错误的是( )
)作用可氧化生成羧酸(或酮)的反应,反应过程如下图所示。下列说法错误的是( )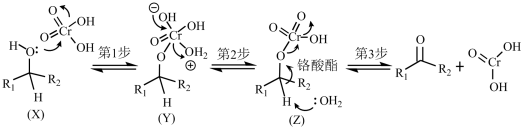
已知:羟基相连的碳上有2个H的醇为一级醇;有1个H的醇为二级醇。
A . 铬在元素周期表中位于第四周期VIB族
B . 铬酸( )只是醇的Jones氧化反应的催化剂
C . 反应物(X)→产物(Z)的反应属于酯化反应
D . 若R1为-H、R2为-C2H5 , 则最终氧化产物为丙酸
)只是醇的Jones氧化反应的催化剂
C . 反应物(X)→产物(Z)的反应属于酯化反应
D . 若R1为-H、R2为-C2H5 , 则最终氧化产物为丙酸
 )只是醇的Jones氧化反应的催化剂
C . 反应物(X)→产物(Z)的反应属于酯化反应
D . 若R1为-H、R2为-C2H5 , 则最终氧化产物为丙酸
)只是醇的Jones氧化反应的催化剂
C . 反应物(X)→产物(Z)的反应属于酯化反应
D . 若R1为-H、R2为-C2H5 , 则最终氧化产物为丙酸
最近更新



