微粒半径大小的比较 知识点题库
短周期元素W、X、Y、Z的原子序数依次增大。m、P、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如下图所示。下列说法正确的是( )

A . q与s均为酸性氧化物
B . 原子半径:W<Y<X
C . Z的氢化物比Y的氢化物稳定
D . Z的含氧酸是一种强酸
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6.下列说法正确的是( )
A . Y元素最高价氧化物对应的水化物化学式出H2YO4
B . 原子半径由小到大的顺序为:X<Z<Y
C . Y、Z两种元素的气态氢化物中,Z的气态氢化物最稳定
D . X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2
短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
-
(1) 写出D与E以1:1的原子个数比形成的化合物的电子式: ,F的原子结构示意图为。
-
(2) B,D形成的化合物 BD2中存在的化学键为 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为化合物。
-
(3) 化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为。
-
(4) A,C,D,E的原子半径由大到小的顺序是(用元素符号表示)。
-
(5) 元素B和F的非金属性强弱,B的非金属性于F(填“强”或“弱”),并用化学方程式证明上述结论。
短周期元素X、Y、Z、W、M的原子序数依次增大且不含稀有气体元素,X元素原子核内只含1个质子且与W同主族,Y的最外层电子数是次外层电子数2倍,Z、M同主族且能形成两种常见的化合物。则下列说法中错误的是( )
A . Y单质的氧化性小于Z单质
B . 元素简单离子的半径大小为M>Z>W>X
C . Y2X4与X2M均能使溴水褪色,且褪色原理相同
D . X、Z、W形成的化合物中既含离子键又含共价键
几种短周期元素的原子半径及主要化合价见下表:
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.186 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +1 | -2,+4,+6 | +3 | -2 |
根据表中信息,判断以下说法正确的是( )
A . 单质与稀硫酸反应的速率快慢:R>X>Y
B . 离子半径:T2->X2+
C . 元素最高价氧化物的水化物的碱性:Y>R>X
D . 单质与氢气化合由易到难:Z>T
A、B、C、D 是原子序数依次增大的短周期主族元素,已知 A、C 原子最外层电子数均为 a,且 A 的次外 层电子数为 a/3,B3+离子与 A 原子电子层数相同。下列叙述错误的是( )
A . 原子半径大小 B>C>D
B . A,C,D 任意两种元素之间均可形成共价化合物
C . 工业上电解 A 和 B 形成的氧化物冶炼 B
D . 气态氢化物的稳定性 A>C>D
短周期元素 A、B、C、D,在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多,请回答下列问题

-
(1) C 在元素周期表中的位置。
-
(2) 比较 A、B、C 元素原子半径的大小: >> (填微粒符号)。
-
(3) F 与 D 同主族且相邻, D 的氢化物比 F 的氢化物稳定的根本原因:。
-
(4) 元素 B 形成的烷烃是有机物中非常重要的一类物质,已知某烷烃 X 的密度在同温同压下是 H2 的 43 倍,那么该烷烃 X 的分子式为 ,0.1mol 烷烃 Y 完全燃烧,消耗标准状况下的 O2 11.2L,那么该烃的分子式为 。
如图所示为元素周期表的一部分,下列说法中正确的是( )

A . Z元素的最高价氧化物对应的水化物能与X的最简单气态氢化物的水溶液反应
B . X、Y、Z、W元素形成的原子半径由小到大的顺序为X<Y<W<Z
C . X和W与氢元素均能形成18电子的分子
D . X、Z两种元素的氧化物中所含化学键的类型相同
下列物质之间的关系与微粒半径大小无关的是( )
A . 熔点:  B . 熔点:金刚石>硅单质
C . 沸点:水晶>氯化锂
D . 热分解所需温度:
B . 熔点:金刚石>硅单质
C . 沸点:水晶>氯化锂
D . 热分解所需温度: 
 B . 熔点:金刚石>硅单质
C . 沸点:水晶>氯化锂
D . 热分解所需温度:
B . 熔点:金刚石>硅单质
C . 沸点:水晶>氯化锂
D . 热分解所需温度: 
短周期主族元素W、X、Y、Z的原子序数依次增大,W的一种同位素可用于考古时测定一些文物的年代,Y是短周期中金属性最强的元素,X、Z同主族,Y与W原子的电子数之差等于X原子的最外层电子数。下列说法错误的是( )
A . W能形成多种氢化物
B . 原子半径:  C . X的最高价氧化物的水化物是弱酸
D . 简单氢化物的稳定性:
C . X的最高价氧化物的水化物是弱酸
D . 简单氢化物的稳定性: 
 C . X的最高价氧化物的水化物是弱酸
D . 简单氢化物的稳定性:
C . X的最高价氧化物的水化物是弱酸
D . 简单氢化物的稳定性: 
下表是元素周期表的一部分,回答下列有关问题(用化学符号回答):
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
① |
② |
③ |
|||||
|
3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
||
|
4 |
⑩ |
-
(1) 在①~⑩元素中,最活泼的金属元素是,最活泼的非金属元素是,最不活泼的元素是,非金属气态氢化物最稳定的是,原子半径最大的是,可做半导体材料的是。(填元素符号)
-
(2) 在①~⑩元素中,⑧的氢化物是,最高价氧化物对应的水化物中碱性最强的是,呈两性的是。写出在水溶液中三者之间相互反应的离子方程式:,,。
为降低空气中可吸入颗粒物的含量,在路面喷洒XY2溶液作保湿剂。X质子数为20,X的阳离子与Y的阴离子电子层结构相同。Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。下列说法正确的是( )
A . X的阳离子比Y的阴离子半径大
B . XY2和WZ2均属于离子化合物
C . H2Z比 HY热稳定性强
D . XY2中仅含离子键,WZ2中仅含极性共价键
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A . X、Y、Z、W的原子半径依次减小
B . 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
C . W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D . W与X形成的化合物只含离子键
已知短周期元素的离子aW2+、b X+、cY2-、d Z- 具有相同的电子层结构,下列正确的是( )
A . 原子序数:a > b > c > d
B . 离子的还原性:Y2- > Z-
C . 氢化物的稳定性H2Y > HZ
D . 原子半径X < W
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化趋势如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期中金属性最强的元素;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。原子半径下列说法正确的是( )

A . 最高化合价:X>Y>Z>W
B . Z的氢化物在水溶液中能形成一种强碱
C . 元素X、Z均能与W形成多种化合物
D . Y的氧化物能与Z的最高价氧化物对应的水化物反应
下表是元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:

-
(1) ③在元素周期表中的位置是,⑨的一种核素的中子数是20,表示该核素的符号是。
-
(2) ③、⑤、⑧三种元素的离子半径由大到小的顺序是(用离子符号表示)。①分别与④、⑨形成化合物的稳定性强弱的顺序是(用化学式表示)。
-
(3) ①、③、⑤形成的化合物中含有化学键的类型是;写出①、②和⑨形成的盐的电子式。
-
(4) ⑤和⑦的最高价氧化物对应的水化物发生反应的离子方程式是。
-
(5) 下列事实能判断⑤和⑥的金属性强弱的是(填字母)。
a.最高价氧化物对应的水化物的碱性强弱
b.常温下单质与水反应置换出氢的难易程度
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
d.单质的硬度、熔点高低
短周期主族元素X、Y、Z、W、R的原子序数依次增加,X、Y、W位于不同周期,原子序数:3Y=Z+R,常温下X与Y可组成两种液态二元化合物。某种缓冲溶液的主要成分结构如图。下列说法错误的是( )

A . R的最高价氧化物对应的水化物为强酸
B . 简单氢化物的稳定性:Y<Z
C . X、W均能与Y形成具有漂白性的化合物
D . 简单离子半径:Y>Z>W
下面叙述正确的是( )
A . 氧族元素氢化物的沸点随原子序数的增大而增大
B . 离子半径大小: C . 第一主族元素都只有正价,无负价
D . P,S,Cl三种元素氧化物的水化物的酸性依次增强
C . 第一主族元素都只有正价,无负价
D . P,S,Cl三种元素氧化物的水化物的酸性依次增强
 C . 第一主族元素都只有正价,无负价
D . P,S,Cl三种元素氧化物的水化物的酸性依次增强
C . 第一主族元素都只有正价,无负价
D . P,S,Cl三种元素氧化物的水化物的酸性依次增强
X、Y、Z、W四种元素是原子序数依次增大的短周期元素,X是原子半径最小的元素,Y元素的单质可以通过分离空气得到,且可使带火星的木条复燃,Z所在的周期数等于族序数,W的最高正化合价与最低化合价的和为4,下列判断正确的是( )
A . 原子半径大小W>Z>Y
B . Z元素的最高价氧化物对应水化物是强碱
C . W元素的氧化物只有一种
D . X和Y元素可以形成原子个数比为1:1的共价化合物
短周期主族元素 、
、 、
、 、
、 原子序数依次增大,
原子序数依次增大, 原子核外电子只有一种自旋取向,
原子核外电子只有一种自旋取向, 、
、 两种原子核外
两种原子核外 能级上的电子总数与
能级上的电子总数与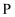 能级上电子总数相等,
能级上电子总数相等, 原子的价电子中,在不同形状的原子轨道中运动的电子数相等。下列说法正确的是( )
原子的价电子中,在不同形状的原子轨道中运动的电子数相等。下列说法正确的是( )
 、
、 、
、 、
、 原子序数依次增大,
原子序数依次增大, 原子核外电子只有一种自旋取向,
原子核外电子只有一种自旋取向, 、
、 两种原子核外
两种原子核外 能级上的电子总数与
能级上的电子总数与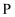 能级上电子总数相等,
能级上电子总数相等, 原子的价电子中,在不同形状的原子轨道中运动的电子数相等。下列说法正确的是( )
原子的价电子中,在不同形状的原子轨道中运动的电子数相等。下列说法正确的是( )
A . 原子半径: B .
B .  的第一电离能比同周期相邻元素的大
C .
的第一电离能比同周期相邻元素的大
C .  与
与 形成的化合物属于分子晶体
D .
形成的化合物属于分子晶体
D .  最高价氧化物对应的水化物属于强酸
最高价氧化物对应的水化物属于强酸
 B .
B .  的第一电离能比同周期相邻元素的大
C .
的第一电离能比同周期相邻元素的大
C .  与
与 形成的化合物属于分子晶体
D .
形成的化合物属于分子晶体
D .  最高价氧化物对应的水化物属于强酸
最高价氧化物对应的水化物属于强酸
最近更新



