微粒半径大小的比较 知识点
微粒半径大小比较:根据测定方法的相同的微粒:原子或离子进行比较,有些离子具有相同的核外电子排布的离子也可进行比较,对于单原子的稀有气体的原子半径也可进行比较,半径的比较方法之一是根据电子层的多少进行比较,半径是原子核核心到最外层的距离。
微粒半径大小的比较 知识点题库
下列有关物质性质的说法错误的是( )
A . 热稳定性:HCl>HI
B . 原子半径:Na>Mg
C . 酸性:H2SO3>H2SO4
D . 结合质子能力:S2﹣>Cl﹣
下列有关性质的比较正确的是( )
A . 原子半径:P < S < Cl
B . 非金属性:P > S > Cl
C . 酸性:H3PO4< H2SO4 < HClO4
D . 稳定性:PH3 > H2S > HCl
X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
-
(1) 上述元素中,金属性最强的在周期表中的位置是;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是。
-
(2) 表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是(填化学
式),其电离方程式为。
-
(3) M与Z相比,非金属性较强的是(填元素名称),请从原子结构的角度说明理由。
-
(4) 在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
 KMnO4+
KMnO4+  H2O2+
H2O2+  H2SO4 →
H2SO4 →  K2SO4+
K2SO4+  MnSO4+
MnSO4+  O2↑+
O2↑+  H2O
H2O请配平 ,当有0.5 mol H2O2参加此反应,电子转移的个数为。
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A . 原子序数 d>c>b>a
B . 原子半径:r(A)>r(B)>r(D)>r(C)
C . 单质的还原性:A>B>D>C
D . 离子半径:r(C3-)> r(D-)> r(B+)> r(A2+)
短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数的电子数之和。下列说法错误的是( )
![]()
A . 最简单的氢化物的沸点:X>W
B . 元素的非金属性:Z>W>Y
C . 简单离子的半径大小:Y>W>Z
D . 氧化物对应水化物的酸性:Y<W<Z
短周期元素X、Y、Z、W原子序数依次增加,其中只有Z为金属元素,X、W为同一主族元素。X元素原子的L层电子是K层的两倍;点燃条件下,Z的单质在X与Y形成的最高价化合物甲中能发生反应生成化合物乙和X的单质。下列判断错误的是( )
A . W的单质可做半导体材料
B . Z可能位于元素周期表第三周期ⅡA族
C . 4种元素的原子中,Y原子的半径最小
D . 工业上通过电解化合物乙来制取乙的单质
下列元素的原子半径最大的是( )
A . O
B . Al
C . Na
D . Cl
元素X、Y、Z和Q在周期表中的位置如图所示,其中元素Q位于第四周期,X、Y、Z原子的最外层电子数之和为17,下列说法不正确的是( )
| X | |||
| Y | Z | ||
| Q |
A . 原子半径(r):r(Q)>r(Y)>r(Z)
B . 元素X有 -4,+2、+4等多种价态
C . Y、Z的氧化物对应的水化物均为强酸
D . 可以推测H3QO4是Q的最高价氧化物的水化物
a、b、c、d、e、f、g为原子序数依次增大的短周期主族元素。b、c、d原子最外层电子数之和为15,且均能与a形成10电子分子,e的单质可用于焊接钢轨,f与d位于同一主族,f与g位于同一周期。下列说法正确的是( )
A . 最高价氧化物对应水化物的酸性:g>b>f
B . 简单气态氢化物的稳定性:b>c>d
C . 简单离子半径:d<e<f
D . 含有e、f等元素的某种化合物可用于净水
随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。下列说法错误的是( )
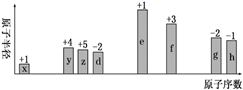
A . zh3中各原子最外层都达到8e-稳定结构
B . y与g可形成化合物yg2 , 结构式为g=y=g
C . d和f形成的简单离子半径大小关系为:d2- < f3+
D . f 和h 形成的化合物属于离子化合物
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是( )
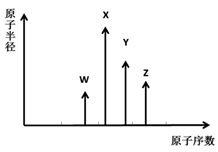
A . 对应简单离子半径:W<X
B . 对应气态氢化物的稳定性:Y>Z
C . 化合物XZW既含离子键,又含极性共价键
D . Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
A、B、C、D四种短周期元素,原子序数依次增大,其元素特征信息如下表所示:
| 元素编号 | 元素特征信息 |
| A | 单质常温下为气体,被人们看做理想的“绿色能源” |
| B | 地壳范围内含量最多的元素 |
| C | 焰色反应显黄色 |
| D | C、D同周期,该周期中D的简单离子半径最小 |
下列说法错误的是( )
A . 113号元素与D同主族
B . 原子半径D>C>B>A
C . C单质与水反应所得的强碱性溶液中含有两种电子数相同的阴、阳离子
D . C、D的最高价氧化物水化物之间能发生反应,生成一种正四面体构型的离子
A、B、C、D均属于短周期元素。A是元素周期表所有元素中原子半径最小的;B和C都只有两个电子层,B中一层电子数是另一层的两倍;C中两层电子数之和是两层电子数之差的两倍;D中一层电子数是另两层电子数之和。下列说法中正确的是( )
A . C的简单离子的还原性大于D
B . D元素只能以化合态存在于自然界中
C . A元素所形成离子的半径有可能大于He原子的半径
D . B、D的原子不能相互结合形成化合物
下表是元素周期表的一部分,请按照元素①-⑦在表中的位置,用化学用语回答下列问题:
|
① |
② |
|||||||
|
③ |
④ |
⑤ |
⑥ |
⑦ |
-
(1) ①-⑦元素中原子半径最大的是;
-
(2) ②、⑦两种元素所形成的气态氢化物中最稳定的是;
-
(3) 元素⑥的化合物中,属于空气主要污染物的是;
-
(4) 写出③和④两种元素的最高价氧化物对应水化物反应的离子方程式;
-
(5) 元素⑦单质的与水反应的方程式是。
已知X、Y、Z、M、N均为短周期主族元素。25℃时,各元素最高价氧化物对应水化物的溶液(浓度均为0.01mol·L-1)的pH和原子序数的关系如图所示。下列说法正确的是( )
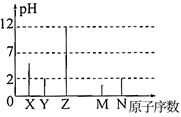
A . 原子半径大小顺序:Z>Y>X
B . 五种元素的氢化物均为共价化合物
C . 最高价氧化物对应的水化物的酸性:M>N
D . Z的常见氧化物中阴、阳离子个数比均为1∶2
短周期元素W、R、X、Y、Z原子序数依次增大,可形成甲、乙(结构如图)两种具有强还原性的物质,且X、Z同主族。下列说法错误的是( )
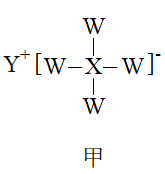
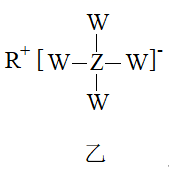
A . W、X分别是氢元素和硼元素
B . 五种元素中,Y原子半径最大
C . Z元素最高价氧化物对应的水化物具有两性
D . 单质Y和R在空气中均可燃烧,燃烧产物所含化学键类型完全相同
我国嫦娥五号探测器带回1.731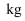 的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,W元素基态原子2p能级仅有一对成对电子。基态X原子的价电子排布式为
的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,W元素基态原子2p能级仅有一对成对电子。基态X原子的价电子排布式为 。基态Z元素原子最外电子层上s、p电子数相等,下列结论正确的是( )
。基态Z元素原子最外电子层上s、p电子数相等,下列结论正确的是( )
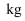 的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,W元素基态原子2p能级仅有一对成对电子。基态X原子的价电子排布式为
的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,W元素基态原子2p能级仅有一对成对电子。基态X原子的价电子排布式为 。基态Z元素原子最外电子层上s、p电子数相等,下列结论正确的是( )
。基态Z元素原子最外电子层上s、p电子数相等,下列结论正确的是( )
A . 原子半径大小顺序为X
某锂盐的结构如图所示,其阴离子是由原子序数依次增大的短周期主族元素X、Y,Z、W形成,X,Y与Z同一周期,Y与W同族。下列说法正确的是( )
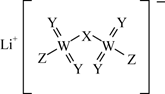
A . 元素的电负性: 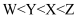 B . 第一电离能:
B . 第一电离能: 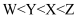 C . 简单气态氢化物的热稳定性:
C . 简单气态氢化物的热稳定性: 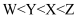 D . 简单离子的半径:
D . 简单离子的半径: 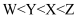
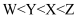 B . 第一电离能:
B . 第一电离能: 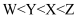 C . 简单气态氢化物的热稳定性:
C . 简单气态氢化物的热稳定性: 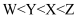 D . 简单离子的半径:
D . 简单离子的半径: 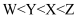
我国“祝融号”火星车成功着陆火星,其矿脉中含有原子序数依次增大的短周期主族元素W、X、Y、Z。已知W、Z同主族,且Z的原子序数是W的2倍,X的氢化物可用于蚀刻玻璃,Y与Z最外层电子数之和等于8。下列说法正确的是( )
A . 离子半径:Z>Y>W>X
B . 同周期第一电离能小于Z的元素有4种
C . X与Y可形成共价化合物YX2
D . 简单氢化物的还原性:W的氢化物>Z的氢化物
M、W、X、Y、Z是原子序数依次增大的前四周期元素,其元素性质或基态原子结构如表。
元素 | 元素性质或原子结构 |
M | 宇宙中含量最多的元素 |
W | 价层电子排布是nsnnpn-1 |
X | 最外能层中的最高能级不同轨道均填充有电子,且自旋方向相同 |
Y | 最外层电子数是次外层电子数的一半 |
Z | +3价阳离子中电子所占据的最高能级处于半充满状态 |
下列说法错误的是( )
A . 原子半径:W>X>M
B . 电负性:X>Y
C . 元素W、Y的单质均可做半导体材料
D . Z位于元素周期表的ds区
最近更新



