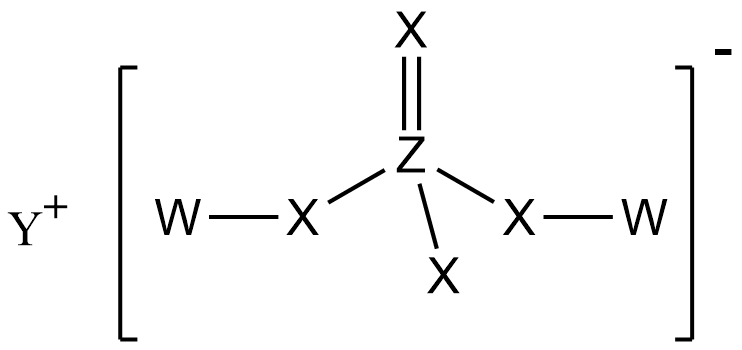化学键 知识点题库
-
(1) 熔化时不需要破坏化学键的是,熔化时需要破坏共价键的是,熔点最高的是.
-
(2) 只有离子键的物质是,既有离子键又有共价键的物质是,晶体以分子间作用力结合的是.
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。请回答:
-
(1) 科学研究表明用TiO2作光催化剂可将废水中CN−转化为OCN−、并最终氧化为N2、CO2。OCN—中三种元素的第一电离能由大到小的顺序为。与OCN−互为等电子体的一种分子为(填化学式)。
-
(2) Ti(BH4)2是一种储氢材料。写出基态Ti2+的电子排布式,BH4−中B原子的杂化轨道类型是。
-
(3) [Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为;
已知CrO5中Cr为+6价,则CrO5的结构式为。
-
(4) 金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4 , 该物质晶胞呈正四面体构型。试推测Ni(CO)4的晶体类型为,Ni(CO)4易溶于下列(填选项字母)中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
-
(5) FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点NiO FeO(填“>”或“<”),原因为。
-
(6)
硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,则该晶胞中硒原子的配位数为;若该晶胞密度为ρ g·cm−3 , 硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为pm。
 B . NH4Cl的电子式为
B . NH4Cl的电子式为 -
(1) 下面是我们熟悉的物质:
①O2②SO2③CaCl2④HNO3⑤NaOH ⑥NH4Cl
这些物质中,属于共价化合物的是 ;属于离子化合物的是;只含离子键的是。
-
(2) 下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。


把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第ⅡA族元素的最外层电子数。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径。
③第二、三周期主族元素随原子序数递增原子半径的变化。
-
(3) 已知某单核粒子的结构示意图为:
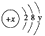
①当x-y=10时,该粒子为(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,该微粒的符号是。
-
(4) 已知A、B、C、D是中学化学中常见的四种10电子微粒,
它们之间存在如图中转化关系。
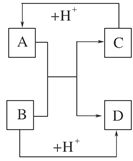
请写出:A的化学式(写一种);D的化学式。
-
(1) 铬(Cr)的价电子排布图为
-
(2) 亚铁氰化钾别名黄血盐,化学式:
 ,加入食盐中可防止食盐板结。其中C、N、O三元素的第一电离能由小到大顺序为。O和N的简单氢化物沸点明显高于CH4原因是,其不含结晶水的盐结构如图所示,其中C原子的杂化方式为。
,加入食盐中可防止食盐板结。其中C、N、O三元素的第一电离能由小到大顺序为。O和N的简单氢化物沸点明显高于CH4原因是,其不含结晶水的盐结构如图所示,其中C原子的杂化方式为。 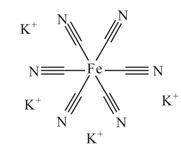
-
(3) 1mol的
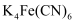 中含有的共价键物质的量为mol,该配位化合物的配位原子为。
中含有的共价键物质的量为mol,该配位化合物的配位原子为。
-
(4) 用实验可以直接确定某固体是否是晶体,某种铁铬合金的晶胞如图所示,该晶体堆积模型为,空间利用率是;若已知该晶胞的棱长为a pm,则该晶胞的密度为g/cm3。

①用电子式表示MgCl2的形成过程为: ![]()
②两个不同种非金属元素的原子间形成的化学键都是极性键
③离子化合物在熔融状态时能够导电
④含有非极性键的化合物一定是共价化合物
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥次氯酸的电子式: ![]()
⑦离子化合物中一定含有离子键
-
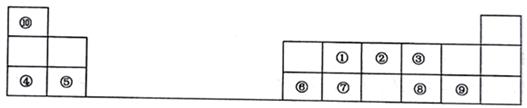
(1) 元素⑤形成的氧化物的电子式为;①、⑦两种元素的最高价氧化物的熔点较高的是(填化学式)。
-
(2) ①~⑨元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
-
(3) 由③④⑩三种元素组成的离子化合物中所含有的化学键有。
-
(4) ①的单质与②的最高价氧化物的水化物的浓溶液反应的化学方程式为。
-
(5) 下列事实能说明③非金属性比⑧强的有(填字母)。
a.通常状况下,③的单质是无色气体,⑧的单质是固体
b.③的单质与⑧的氢化物溶液反应,溶液变浑浊
c.③与⑧两元素的简单氢化物受热分解,前者的分解温度高
d.常温常压下,③与⑧两元素的简单氢化物的沸点,前者高

 和
和  中碳原子的杂化类型相同
C . 该反应中既有离子键断裂,又有共价键断裂
D .
中碳原子的杂化类型相同
C . 该反应中既有离子键断裂,又有共价键断裂
D .  的分子立体构型是直线形
的分子立体构型是直线形
-
(1) 基态Ga原子的价电子排布式为,基态As原子核外有个未成对电子。
-
(2) 镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577,1985,2962,6192,由此可推知镓的主要化合价为和+3,镓的电负性比砷(填“大”或“小”)。
-
(3) GaAs为原子晶体,其晶胞结构如图所示,则Ga与As以键键合。
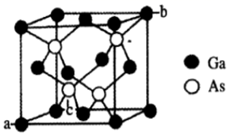

图中a和b的原子坐标参数分别为(0,0,0)和(1,1,1),则c的坐标参数为。