卤素原子结构及其性质的比较 知识点题库
某课外小组同学通过实验发现Cl2和Br2的化学性质相似.下列解释最合理的是( )
A . 都是非金属单质
B . 都是双原子分子
C . 组成元素的最高正化合价相同
D . 组成元素的原子最外层电子数相同
在温度t1和t2下,卤素单质X2(g)和H2反应生成HX的化学平衡常数如下表,仅根据下表数据不能判断的是( )
化学方程式 | K(t1) | K(t2) |
F2+H2⇌2HF | 1.8×1036 | 1.9×1032 |
Cl2+H2⇌2HCl | 9.7×1012 | 4.2×1011 |
Br2+H2⇌2HBr | 5.6×107 | 9.3×106 |
I2+H2⇌2HI | 43 | 34 |
A . 已知t2>t1 , HX的生成反应为放热反应
B . 在相同条件下,X2平衡转化率:F2>Cl2
C . X2与H2反应的剧烈程度随着原子序数递增逐渐减弱
D . HX的稳定性:HBr>HI
下列是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是( )
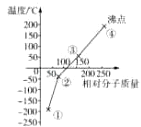
A . 单质①是最活泼的非金属单质
B . 单质②能使品红溶液褪色
C . 单质③在常温下是液态
D . 单质的氧化性强弱顺序是④>③>②>①
随着卤素原子核电荷数的递增,下列递变规律正确的是( )
A . 单质的熔沸点逐渐升高
B . 氢化物的稳定性逐渐增强
C . 单质的氧化性逐渐增强
D . 元素的非金属性逐渐增强
用A、B、C三个装置都可以制取溴苯,其中A是最基本的制备装置,B、C是改进后的装置,请仔细分析、对比三套装置,然后回答以下问题:
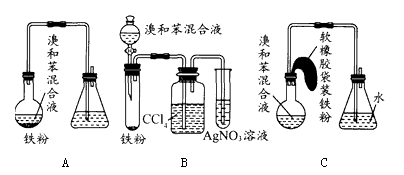
-
(1) 写出三个装置中都发生的发应的化学方程式:、。
-
(2) 装置A和C中均采用了长玻璃导管,其作用是。
-
(3) 装置B和C较好地解决了装置A中存在的加药品和及时密封的矛盾,方便了操作。装置A中这一问题在实验中易造成的不良后果是。
-
(4) 装置B中采用了洗气瓶吸收装置,其作用是。
-
(5) 装置B中也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是、。
下列关于碱金属元素和卤素的说法中,不正确的是( )
A . 钾与水的反应比钠与水的反应更剧烈
B . 溴单质与水的反应比氯单质与水的反应更剧烈
C . 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
D . 碱金属元素中,锂原子失去最外层电子的能力最弱
下列叙述正确的是( )
A . 金属晶体的一个晶胞中所含的原子数:钾型=镁型<铜型
B . 在卤族元素(F、Cl、Br、I)的氢化物中,HF的沸点最低
C . CaH2、Na2O2晶体的阴、阳离子个数比分别为2∶1、1∶1
D . 晶体熔点:金刚石>食盐>干冰>冰
溴( Br ) 与氯同属“卤族”元素, 其单质在性质上具有很大的相似性,但Cl2比 Br2的活泼性更强, 下面是根据氯的性质对溴的性质的预测, 其中正确的是( )
A . 溴单质只具有氧化性
B . 溴蒸气与氢气在加热下反应生成 HBr
C . 溴单质与 NaOH 溶液反应生成 NaBr 和 HBrO
D . 溴原子最外层有 7 个电子,在反应中容易得 l 个电子, 易被氧化
根据要求回答:
-
(1) 乙烯的电子式是。
-
(2) 用一个化学方程式说明氯的非金属性比硫强。
-
(3) 铁粉与水蒸气反应的化学方程式是。取上述反应后的固体适量,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现红色,说明该固体中没有+3价的铁。判断结论是否正确(填“是”或“否”),若不正确说明理由(若结论正确,本空不填)。
最近更新



